Considere:
• Constante universal dos gases ideais: R = 8,0 J.(mol.K)⁻¹ = 0,082 atm.L.(mol.K)⁻¹
• Constante de Faraday = 96500 C.mol⁻¹
• Kₚₛ(PbSO₄) = 1,3×10⁻⁸
• Composição molar do ar atmosférico: 79% de N₂ e 21% de O₂
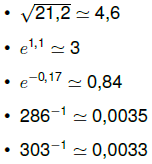
Uma solução de Na₂SO₄ com concentração 1,0 ×10⁻³ mol/L contem, como traçador, o radioisótopo  , cujo tempo de meia vida e igual a 88 dias. Uma amostra de 10 mL dessa solução produz 4,0×10⁴ contagens por minuto em um detector de radiação. Um volume igual de solução de Pb(NO₃)₂ com concentração 2,0 ×10⁻⁴ mol/L e adicionado à solução de Na₂SO₄ , ocasionando precipitação de PbSO₄ .
, cujo tempo de meia vida e igual a 88 dias. Uma amostra de 10 mL dessa solução produz 4,0×10⁴ contagens por minuto em um detector de radiação. Um volume igual de solução de Pb(NO₃)₂ com concentração 2,0 ×10⁻⁴ mol/L e adicionado à solução de Na₂SO₄ , ocasionando precipitação de PbSO₄ .
Calcule o numero de contagens por minuto para uma alíquota de 10 mL retirada da solução após a precipitação.