Olá, pessoal… Tudo bem? Prof. Prazeres na área, professor de Química do Estratégia Vestibulares, escrevendo este artigo para resolver a prova de química do Vestibular da UNESP 2020. Nesta página, você vai conferir os meus comentários e a resolução de todas as questões de química. Você pode também baixar gratuitamente a resolução em PDF. Vamos nessa??
Gabarito UNESP 2020
Questão 69
Um estudante coletou informações sobre a concentração total de sais dissolvidos, expressa em diferentes unidades de medida, de quatro amostras de águas naturais de diferentes regiões. Com os dados obtidos, preparou a seguinte tabela:
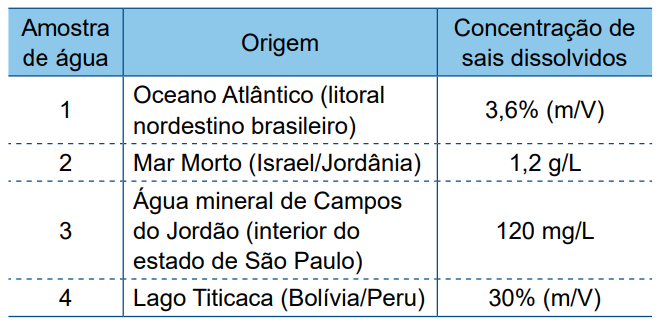
Ao rever essa tabela, o estudante notou que dois dos valores de concentração foram digitados em linhas trocadas. Esses valores são os correspondentes às amostras
(A) 2 e 4.
(B) 1 e 3.
(C) 1 e 2.
(D) 3 e 4.
(E) 2 e 3.
Resolução Comentada
Sabe-se que a ordem crescente de salinidade das amostras de água é: água mineral (3) < lago Titicaca (amostra 4) < oceano atlântico (amostra 1) < mar morto (amostra 2).
É importante destacar que, para soluções aquosas diluídas, a densidade da água é, aproximadamente, a densidade da solução, portanto, a densidade das amostras é próxima de 1 g/mL.
Calcula-se a salinidade, em g/L, das amostras:
A ordem crescente de salinidade qualitativa é água mineral (amostra 3) < lago Titicaca (amostra 4) < oceano atlântico (amostra 1) < mar morto (amostra 2).
A ordem crescente de salinidade quantitativa é: 0,120 g/L < 1,2 g/L < 36 g/L < 300 g/L.
Portanto, a ordem é 120 mg/L ou 0,120 g/L (amostra 3) < 1,2 g/L (amostra 4) < 3,6% m/v ou 36 g/L (amostra 1) < 30% m/v ou 300 g/L (amostra 2).
Segundo a tabela divulgada na questão, os valores das amostras 2 e 4 foram trocados.
Gabarito: A
Questão 70
Parque Eólico de Osório, RS

O Parque Eólico de Osório é o maior da América Latina e o segundo maior do mundo em operação. Com capacidade produtiva total de 150 MW, tem potência suficiente para abastecer anualmente o consumo residencial de energia elétrica de cerca de 650 mil pessoas.
(www.osorio.rs.gov.br. Adaptado.)
Considere agora a combustão completa do metano, principal componente do gás natural, cuja entalpia de combustão completa é cerca de – 9 × 102 kJ/mol, e que as transformações de energia nessa combustão tenham eficiência ideal, de 100%.
Para fornecer a mesma quantidade de energia obtida pelo Parque Eólico de Osório quando opera por 1 hora com sua capacidade máxima, uma usina termoelétrica a gás necessitaria da combustão completa de uma massa mínima de metano da ordem de
(A) 10 t.
(B) 5 t.
(C) 25 t.
(D) 15 t.
(E) 20 t
Resolução Comentada
Potência: 150 MW = 150·106 W = 150·106 J/s · 3600 s = 540000·106 = 54·1010 J
Gabarito A
Questão 71
Analise as estruturas das clorofilas a e b.
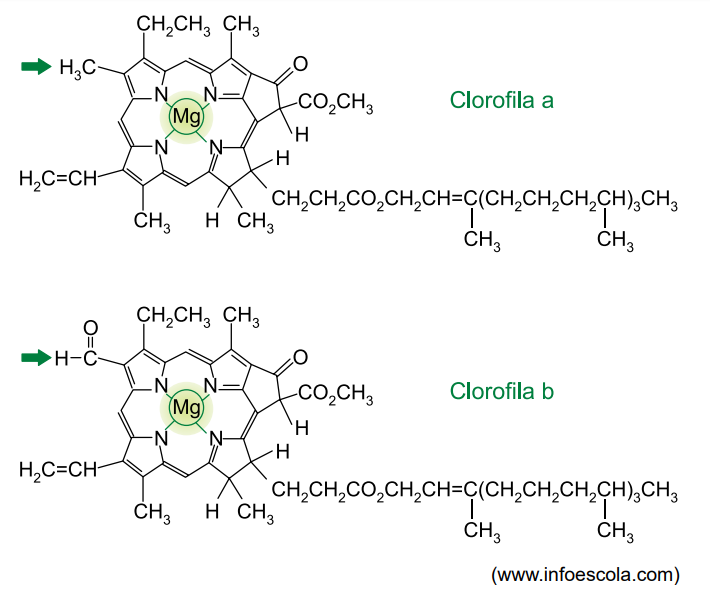
As clorofilas a e b estão presentes na estrutura celular denominada ________________, sendo que a clorofila ______________ é a principal responsável pelo processo de fotossíntese. Nas duas clorofilas, o elemento magnésio encontra-se sob a forma de íons com número de carga _______________. A diferença entre as duas estruturas é a presença, na clorofila b, de um grupo da função orgânica _________________, em vez de um dos grupos metil da clorofila a.
As lacunas do texto são preenchidas, respectivamente, por:
(A) cloroplasto ; a ; 2+ ; aldeído.
(B) cloroplasto ; b ; 2+ ; cetona.
(C) complexo golgiense ; a ; 1+ ; aldeído.
(D) cloroplasto ; a ; 1+ ; aldeído.
(E) complexo golgiense ; b ; 2+ ; cetona.
Resolução Comentada
O cloroplasto é a organela citoplasmática, responsável pela fotossíntese. Nesse processo, a energia luminosa é transformada em energia química devido à presença de clorofila nesses organelas, as quais captam a luz solar.
Em plantas, dois são os principais tipos de clorofila, a clorofila ‘a’ e a clorofila ‘b’, sendo a clorofila ‘a’ a mais importante, pois participa das fosforilações cíclica e acíclica da etapa fotoquímica, enquanto a clorofila ‘b’ participa apena da fosforilação acíclica.
O magnésio, em sua forma iônica, apresenta valência fixa, porque é um metal alcalino terroso. Portanto, a valência do íon magnésio é +2.
As funções orgânicas aldeído e cetona são identificadas por:

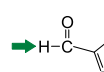
A carbonila da clorofila b está ligada ao átomo de hidrogênio, portanto, essa função orgânica é um aldeído.
Gabarito: A
Questão 72
As antocianinas existem em plantas superiores e são responsáveis pelas tonalidades vermelhas e azuis das flores e frutos. Esses corantes naturais apresentam estruturas diferentes conforme o pH do meio, o que resulta em cores diferentes.
O cátion flavílio, por exemplo, é uma antocianina que apresenta cor vermelha e é estável em pH ≈ 1. Se juntarmos uma solução dessa antocianina a uma base, de modo a ter pH por volta de 5, veremos, durante a mistura, uma bonita cor azul, que não é estável e logo desaparece.
Verificou-se que a adição de base a uma solução do cátion flavílio com pH ≈ 1 dá origem a uma cinética com 3 etapas de tempos muito diferentes. A primeira etapa consiste na observação da cor azul, que ocorre durante o tempo de mistura da base. A seguir, na escala de minutos, ocorre outra reação, correspondendo ao desaparecimento da cor azul e, finalmente, uma terceira que, em horas, dá origem a pequenas variações no espectro de absorção, principalmente na zona do ultravioleta.
(Paulo J. F. Cameira dos Santos et al. “Sobre a cor dos vinhos: o estudo das antocianinas e compostos análogos não parou nos anos 80 do século passado”. www.iniav.pt, 2018. Adaptado.)
A variação de pH de ≈1 para ≈5 significa que a concentração de íons H+ (aq) na solução , aproximadamente, vezes. Entre as etapas cinéticas citadas no texto, a que deve ter maior energia de ativação e, portanto, ser a etapa determinante da rapidez do processo como um todo é a . As lacunas do texto são preenchidas, respectivamente, por:
(A) aumentou ; 10000 ; primeira.
(B) aumentou ; 10000 ; terceira.
(C) diminuiu ; 10000 ; terceira.
(D) aumentou ; 5 ; terceira.
(E) diminuiu ; 5 ; primeira.
Resolução Comentada
O pH é uma função logarítmica utilizada para comparar acidez de soluções aquosas, quanto menor o valor do pH, maior a acidez. O pH é calculado por:
Ao aumentar o pH de 1 para 5, a acidez diminui, ou seja, a concentração de H+ diminui.
Assim, tem-se:
A etapa cinética de uma reação química é determinada pela etapa mais lenta. Segundo o texto da questão, a primeira etapa é instantânea, a segunda etapa demora minutos e a terceira etapa demora horas. Portanto, a etapa mais lenta e determinante da rapidez da reação é a etapa 3.
Gabarito: C
Questão 73
Considere um cubo de aço inoxidável cujas arestas medem 1 cm.
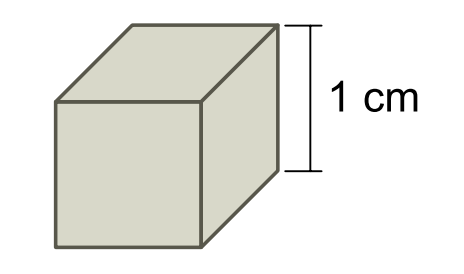
Deseja-se recobrir as faces desse cubo com uma camada uniforme de cobre de 1 × 10-2 cm de espessura. Para isso, o cubo pode ser utilizado como cátodo de uma cuba eletrolítica contendo íons Cu2+(aq). Admita que a eletrólise se realize sob corrente elétrica de 200 mA, que a constante de Faraday seja igual a 1 × 105 C/mol e que a densidade do cobre seja 9 g/cm3. Assim, estima-se que o tempo de eletrólise necessário para que se deposite no cubo a camada de cobre desejada será próximo de
(A) 17000 s.
(B) 2200 s.
(C) 8500 s.
(D) 4300 s.
(E) 3600 s.
Resolução Comentada
Inicialmente, calcula-se o volume de cobre que será utilizado para revestir o cubo de aço. Cada face do cubo apresenta 1 cm · 1 cm · 0,01 cm = 0,01 cm3. O cubo apresenta 6 fases, portanto, o volume necessário de cobre é de 6 · 0,01 = 0,06 cm3.
Sabendo que a densidade do cobre (63,5 g/mol) é de 9 g/cm3, determina-se a massa de cobre consumida do processo:
A reação de redução do cobre é representada por:
Sabe-se que a corrente elétrica utilizada é de 200 mA (ou 200·10-3 A ou 200·10-3 C/s), logo, calcula-se o tempo necessário para transferir 1,7 · 103 C:
Gabarito C
Leia o texto para responder às questões 74 e 75.
Lâmpadas sem mercúrio
Agora que os LEDs estão jogando para escanteio as lâmpadas fluorescentes compactas e seu conteúdo pouco amigável ao meio ambiente, as preocupações voltam-se para as lâmpadas ultravioletas, que também contêm o tóxico mercúrio. Embora seja importante proteger-nos de muita exposição à radiação UV do Sol, a luz ultravioleta também tem propriedades muito úteis. Isso se aplica à luz UV com comprimentos de onda curtos, de 100 a 280 nanômetros, chamada luz UVC, que é especialmente útil por sua capacidade de destruir bactérias e vírus. Para eliminar a necessidade do mercúrio para geração da luz UVC, Ida Hoiaas, da Universidade Norueguesa de Ciência e Tecnologia, montou um diodo pelo seguinte procedimento: inicialmente, depositou uma camada de grafeno (uma variedade cristalina do carbono) sobre uma placa de vidro. Sobre o grafeno, dispôs nanofios de um semicondutor chamado nitreto de gálio-alumínio (AlGaN). Quando o diodo é energizado, os nanofios emitem luz UV, que brilha através do grafeno e do vidro.
(www.inovacaotecnologica.com.br. Adaptado.)
Questão 74
Uma das principais razões que levam o mercúrio a ser considerado “pouco amigável ao meio ambiente” é o fato de esse elemento
(A) ser altamente volátil, poluindo o ar das grandes metrópoles e intensificando o efeito estufa.
(B) interagir com compostos orgânicos de seres vivos, acumulando-se nas cadeias alimentares.
(C) interagir com compostos de enxofre, formando sulfeto de mercúrio (HgS), um composto insolúvel em água.
(D) ocorrer na crosta terrestre sob forma de um metal líquido de baixa densidade.
(E) ser inerte nas condições ambientais, acumulando-se no solo e no leito dos rios.
Resolução Comentada
Julgando os itens, tem-se:
- A) Errado. O mercúrio é líquido a temperatura ambiente e, por isso, produz vapor. Porém, isso não significa dizer que é altamente volátil. O mercúrio, por ser um metal de elevada densidade, apresenta elevada temperatura de ebulição. O efeito estufa é provocado pelo acúmulo de gases que apresentam estiramento assimétrico, destacam-se os gases: CO2, H2O e CH4.
- B) Certo. O mercúrio, zinco, chumbo e magnésio são classificados como elementos organometálicos e são encontrados combinados com compostos orgânicos. Quando o mercúrio se combina com compostos orgânicos, esse elemento é encontrado em maior proporção nos seres vivos.
- C) Errado. A formação do composto insolúvel de mercúrio e enxofre não agrava o acúmulos nos organismos vivos, pois poderia ser expelido pelo organismo.
- D) Errado. O mercúrio é um líquido de elevada densidade e é, majoritariamente, encontrado na forma iônica.
- E) Errado. O elemento mercúrio apresenta um caráter menos reativo quando comparado com boa parte dos metais, porém, não se pode dizer que o elemento mercúrio é um elemento inerte. Os elementos inertes são os gases nobres porque apresentam estabilidade eletrônica quando isolados.
Gabarito: B
Questão 75
No nitreto de gálio-alumínio, os números de oxidação do nitrogênio e do par Al-Ga são, respectivamente,
(A) 0 e 0.
(B) +6 e –6.
(C) +1 e +1.
(D) –3 e +3.
(E) –2 e +2.
Resolução Comentada
O nitreto de gálio-alumínio é um composto iônico formado pela transferência de elétrons. O nitrogênio se estabiliza quando apresenta 3 elétrons, portanto, o nox do nitrogênio é igual a -3. Sabendo que a soma do nox de todos os átomos de uma fórmula iônica neutra é igual a zero, a soma do nox de alumínio-gálio é igual a +3.
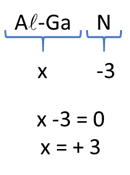
Gabarito: D
Questão 79
Para obter energia térmica, com a finalidade de fundir determinada massa de gelo, produziu-se a combustão de um mol de gás butano (C4H10), a 1 atm e a 25 ºC. A reação de combustão desse gás é:
As entalpias-padrão de formação (ΔH) das substâncias citadas estão indicadas na tabela:
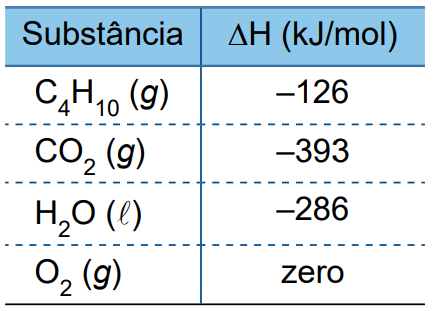
Considerando que a energia térmica proveniente dessa reação foi integralmente absorvida por um grande bloco de gelo a 0 ºC e adotando 320 J/g para o calor latente de fusão do gelo, a massa de água líquida obtida a 0 ºC, nesse processo, pelo derretimento do gelo foi de, aproximadamente,
(A) 7 kg.
(B) 5 kg.
(C) 3 kg.
(D) 10 kg.
(E) 9 kg.
Resolução Comentada
Primeiramente, calcula-se a quantidade de energia, em J, emitida pela reação de combustão do gás butano.
Gabarito: E
Questão 84
Estudos sobre modelos atômicos foram fundamentais para o desenvolvimento da Química como ciência. Por volta de 450 a.C., os filósofos gregos Leucipo e Demócrito construíram a hipótese de que o mundo e, em consequência, a matéria eram constituídos a partir de unidades idênticas e indivisíveis, chamadas átomos. Contudo, foi somente a partir do século XIX que a realização de experimentos tornou possível a comprovação de hipóteses desenvolvidas ao longo do tempo. Um dos primeiros modelos aceitos foi criado por John Dalton, apresentado em um livro de sua autoria, publicado em 1808. Anos depois, outros dois principais modelos foram desenvolvidos, até que, em 1913, o físico Niels Bohr publicou um livro com sua teoria sobre o modelo atômico.
Tomando como referência as datas de publicação dos trabalhos de Dalton e de Bohr, a linha do tempo que apresenta os fatos históricos do desenvolvimento do modelo atômico, com espaço proporcional à distância de tempo entre eles, é:
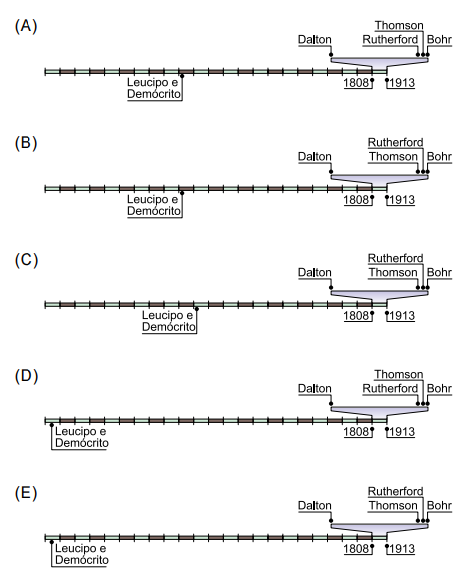
Resolução Comentada
A ordem cronológica das divulgações dos modelos atômicos é: Demócrito e Leucipo, Dalton, Thomson, Rutherford e Bohr.
Ao subtrair 1913 – 1808 tem-se 105 anos, que é o valor de cada retângulo da ilustração.
Segundo o texto, Demócrito e Leucipo lançaram as concepções de átomo em 450 a.C, portanto, determina-se a quantidade de retângulos necessários para a identificação do intervalo na linha do tempo:
Portanto, contando a partir de 1808, a marcação do tempo para a divulgação de Demócrito e Leucipo se encontra entre o 21º e 22º retângulo:
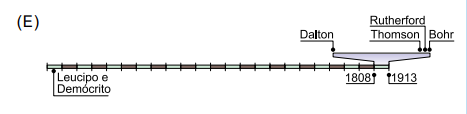
Gabarito: E
É isso, pessoal! Espero que tenham curtido a resolução da prova de Química do vestibular UNESP 2020. Sigam-me nas redes sociais. Têm muitas dicas lá. Mande uma mensagem, caso tenha tido alguma dúvida. Abraços!
Instagram: @professorprazeres


