A termoquímica é a área de conhecimento que estuda as reações químicas e as energias relacionadas com elas, do ponto de vista térmico, principalmente. A entalpia é uma grandeza que pode mensurar esses valores e é estudada por meio da Lei de Hess.
Esse conceito químico-matemático é necessário para a compreensão de reações químicas, em especial aquelas que passam por diferentes etapas para chegar ao resultado final. Em termos de vestíbulares, a Lei de Hess pode ser utilizada para entender se um determinado composto é formado a partir de absorção ou liberação de calor, por exemplo.
Para te ajudar no entendimento da Lei de Hess, entalpia e outros conceitos da termoquímica, o Estratégia Vestibulares preparou um resumo completo com as informações essenciais no tema. Inclusive, foram resolvidas e comentadas questões de prova que abordam esse assunto de forma direta ou indireta.
Navegue pelo conteúdo
O que é Lei de Hess?
Em termos gerais, a Lei de Hess é um padrão químico-matemático utilizado para encontrar a variação de entalpia de reações químicas em um determinado sistema. É a partir desse conceito que surgem grande parte dos conhecimentos termoquímicos.
Uma vez que a Lei de Hess trata sobre a variação de entalpia, é importante entender o que é essa grandeza. A definição de entalpia trata sobre toda a energia interna presente em um corpo, a depender de seu volume e pressão.
Apesar de ser um conceito bem estabelecido, medir a entalpia de um reagente ou produto de uma reação química não é uma tarefa possível. É por isso que a ciência termoquímica foca principalmente em medir a variação da entalpia em uma reação, partindo do estágio inicial até o ponto em que os produtos definitivos são formados.
Cálculos da Lei de Hess
Como foi apresentado até aqui, a Lei de Hess é uma interface entre operações matemáticas com grandezas químicas, que é a entalpia. Diante disso, o cálculo que a representa é dado pela diferença entre a entalpia final do sistema e a entalpia inicial.
Em geral, a grandeza entalpia é representada matematicamente com H. Diante disso, a fórmula será:
ΔH = Hf – Hi
ΔH → variação de entalpia
Hf → entalpia ao final do processo
Hi → entalpia no início do processo
Em geral, a variação de entalpia é fornecida nas unidades de kJ/mol (quiloJoules por mol), sempre considerando condições de temperatura e pressão.
Note que a equação não leva em consideração quaisquer reações químicas intermediárias que aconteçam durante a formação de determinado produto. Então, independentemente do número de reações intermediárias de um processo químico, a entalpia será sempre calculada a partir dos valores de H no início e final de todas as etapas.
Nos casos em que muitas reações químicas intermediárias acontecem entre os reagentes iniciais e os produtos finais, a entalpia pode ser calculada como se fosse uma soma/subtração matemática montada. Observe na resolução de questão abaixo, de forma prática.
(Fuvest) O “besouro bombardeiro” espanta seus predadores expelindo uma solução quente. Quando ameaçado, em seu organismo ocorre a mistura de soluções aquosas de hidroquinona, peróxido de hidrogênio e enzimas, que promovem uma reação exotérmica, representada por:
C6H4(OH)2(aq) + H2O2(aq) → C6H4O2(aq) + 2 H2O(l)
O calor envolvido nessa transformação pode ser calculado, considerando-se os processos:
C6H4(OH)2(aq) → C6H4O2(aq) + H2(g) ΔH = +177 kJ . mol-1
H2O(l) + ½ O2(g) → H2O2(aq) ΔH = +95 kJ . mol-1
H2O(l) → ½ O2(g) + H2(g) ΔH = +286 kJ . mol-1
Assim sendo, o calor envolvido na reação que ocorre no organismo do besouro é:
a) -558 kJ . mol-1
b) -204 kJ . mol-1
c) -177 kJ . mol-1
d) +558 kJ . mol-1
e) +585 kJ . mol-1
Note que o enunciado da questão já fornece qual seria a reação final esperada para esse processo, que é:
C6H4(OH)2(aq) + H2O2(aq) → C6H4O2(aq) + 2 H2O(l)
Diante disso, é importante ordenar as outras reações químicas para que somados e subtraídos, resultem nessa equação química. Lembre-se que quando uma substância é produto de uma reação I e reagente da reação II, significa que ela será formada em uma das etapas para ser gasta em outra — sempre considerando a quantidade em mols da molécula. Diante disso, elas esse tipo de substância tende a não aparecer na equação química final. Acompanhe!
(A) C6H4(OH)2(aq) → C6H4O2(aq) + H2(g) ΔH = +177 kJ . mol-1
Essa reação A foi colocada exatamente como apresentada no enunciado, porque seu primeiro reagente (C6H4(OH)2(aq) ) também aparece como reagente da reação final. Não é necessário fazer multiplicações no número de mols, porque também está equivalente com a ideia final.
(B) H2O(l) + ½ O2(g) → H2O2(aq) ΔH = +95 kJ . mol-1
Nessa equação B, note que existem dois reagentes que não aparecem nos reagentes da equação final, mas a água (H2O) surge como produto. Diante disso, observa-se que o produto H2O2 é reagente da equação final. Isso indica que essa equação deve aparecer invertida no processo químico dentro do besouro. Para inverter a equação é necessário trocar reagentes por produtos e também inverter o sinal da variação de entalpia.
(B) H2O2(aq) →H2O(l) + ½ O2(g) ΔH = – 95 kJ . mol-1
Por fim, na equação:
(C) H2O(l) → ½ O2(g) + H2(g) ΔH = +286 kJ . mol-1
Note que a água aparece também como reagente nessa equação, mas é necessário que seja um produto na reação final. Portanto, é importante inverter também C:
(C) ½ O2(g) + H2(g) → H2O(l) ΔH = -286 kJ . mol-1
Agora, podemos juntar todas as reações já adaptadas, para formar uma equação matemática e somar ou subtrair as substâncias iguais.
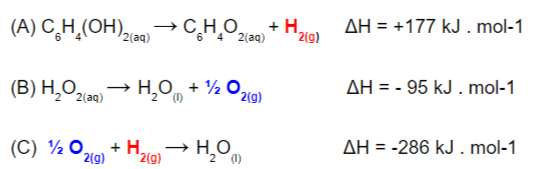
Observe como as substâncias químicas destacadas aparecem no produto e reagente de diferentes reações, com a mesma quantidade. Isso significa que foram formadas e gastas dentro do processo, então podem ser excluídas da reação final.
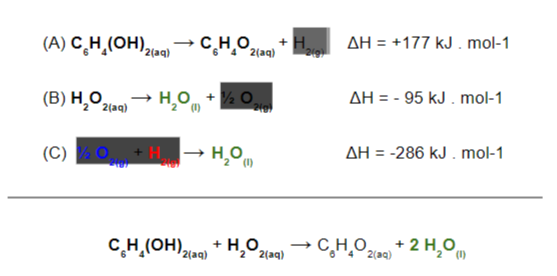
Agora, já foi montada a reação final exatamente como o exercício propôs, então percebemos que o caminho percorrido está correto. Basta, então, somar os valores de reação de entalpia para chegar ao resultado desejado: 177 – 95 – 286 = 204 kJ.mol-1, como propõe a alternativa B.
Diagrama de entalpia
Outra forma de estudar e aplicar a Lei de Hess e as variações de entalpia é por meio de diagramas. Basicamente são representações gráficas que correlacionam o aumento ou redução da entalpia em cada etapa.
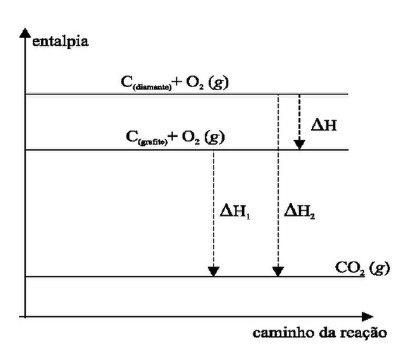
Depois de observar esse quadro, é importante fazer uma síntese das informações, para concluir se ao final do processo a reação é:
- Endotérmica e absorve energia, com valor de ΔH>0;
- Exotérmica e libera energia, com valor de ΔH<0.
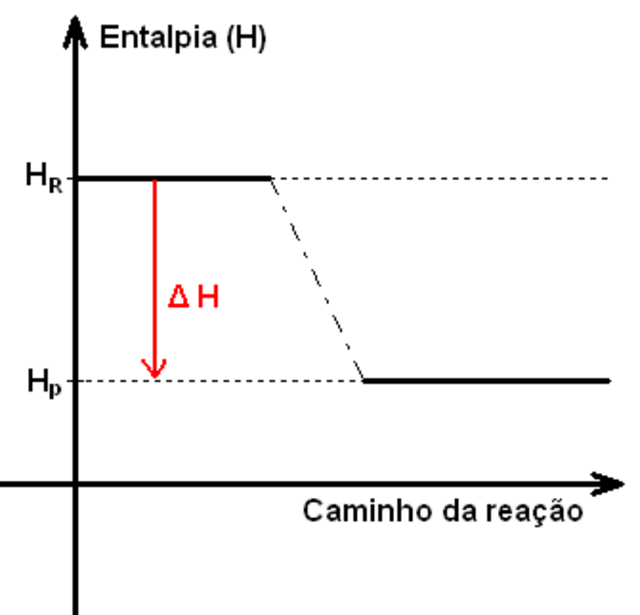
Observe, nesta imagem, que a variação de entalpia parte de um valor alto (HR = Hi) em direção a um valor mais baixo no eixo y. Isso significa que é uma variação negativa, exotérmica, com liberação de energia — geralmente são reações de combustão.
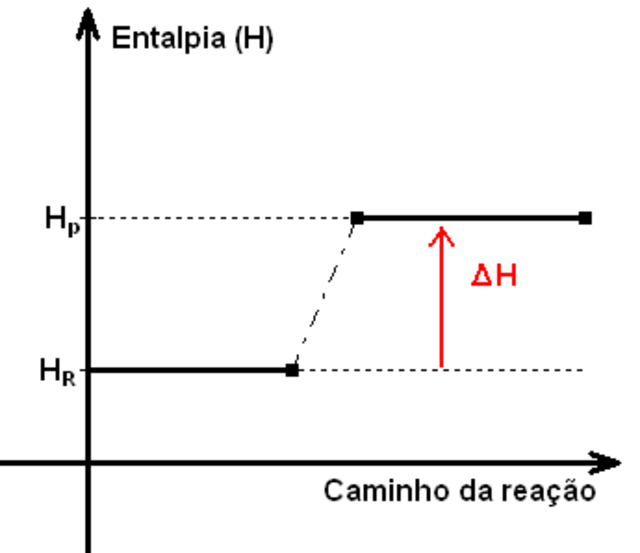
Nesta outra representação, observe como a entalpia final é maior que a inicial. Isso indica que o processo absorveu energia ao longo do processo, o que traz à tona a classificação de reação endotérmica.
Estude mais de química com a Coruja!
A banca de provas da sua faculdade dos sonhos tem testes com primeira e segunda fase? O Estratégia Vestibulares pode te ajudar! Nossos simulados são construídos com base no modelo de prova de cada banca, com gabarito e correção, inclusive para os exercícios discursivos da segunda fase.
Para estudar e consolidar ainda mais os pontos de maior dificuldade, conte com os cursos da Coruja. Além de aulas claras, didáticas e direcionadas, os materiais são acessíveis em diversas plataformas, com ferramentas interativas, possibilidade de anotar e destacar conteúdos. Conheça essa e outras vantagens ao clicar no banner abaixo.