Seja por transferência de elétrons, pelo compartilhamento deles ou por meio do “mar eletrônico”, os elementos se associam e criam ligações químicas. Você quer entender melhor como funcionam esses processos?
Acompanhe este artigo, que tratará sobre os diferentes tipos de interações químicas e suas características. Além disso, veja exemplos de como esse assunto pode ser cobrado nos vestibulares. Vamos lá?
Navegue pelo conteúdo
Teoria do Octeto
Quando os átomos realizam ligações químicas, estão envolvidos na estabilização de suas eletrosferas. De modo que transferem, compartilham ou liberam os elétrons até que a disposição eletrônica alcance o maior equilíbrio possível para o contexto.
Segundo a teoria do octeto, proposta pelo químico Gilbert Newton Lewis e pelo físico Walter Kossel, a maioria dos átomos estão mais estáveis quando apresentam 8 elétrons na camada de valência — a camada mais externa da distribuição eletrônica.
Vale lembrar que essa regra possui diversas exceções, como em alguns metais de transição ou nos elementos Hélio e Hidrogênio que se estabilizam com apenas 2 elétrons no nível de valência.
Ligação química iônica
Para alcançar a estabilidade proposta na teoria do octeto, alguns átomos transferem seus elétrons a outros átomos. Tal configuração é chamada de ligação iônica e pode ocorrer com:
- Ametal + metal; ou
- Metal + hidrogênio.
Nesse caso, o elemento que envia elétrons é chamado de cátion e assume uma carga positiva. Já o átomo que recebe as partículas negativas é denominado por ânion, adquirindo carga negativa. Veja uma imagem representativa:
A reação iônica pode ser descrita genericamente como:
Ax+ + By- → AyBx
Na+ + Cl– → NaCl
A ligação iônica produz compostos:
- Sólidos na temperatura ambiente;
- Com dureza própria da substância;
- Com alto ponto de fusão e ebulição, para as condições ambientes;
- Que formam retículos cristalinos, como o sal de cozinha (NaCl); e
- Que, quando dissolvidos em água ou fundidos, conduzem corrente elétrica.
Ligação química covalente
As ligações químicas covalentes, por sua vez, acontecem quando átomos de ametais compartilham elétrons entre si. Para isso, formam pares eletrônicos que participam de ambas as eletrosferas, veja no esquema a seguir:
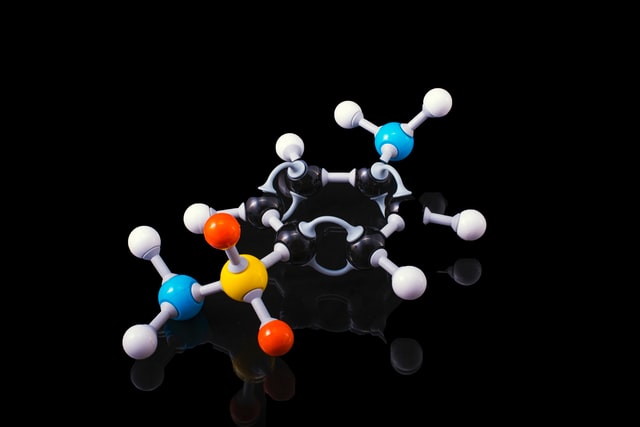
Nesse caso, átomos de hidrogênio, que apresentam um elétron na camada de valência, interagem para que os dois tenham um par de elétrons nesse nível eletrônico. De forma que eles se estabilizam covalentemente.
Na imagem abaixo, o átomo de hidrogênio se associa com átomos de diferentes elementos, compartilhando seu elétron e formando ligações covalentes. Observe atentamente.
Os compostos químicos resultantes de ligações covalentes possuem as seguintes propriedades:
- Podem estar em estado físico sólido (açúcar), líquido (água) ou gasoso (gás oxigênio);
- São muito comuns em substâncias orgânicas;
- Não conduzem eletricidade; e
- Apresentam ponto de fusão e ebulição baixos.
Veja, na questão adaptada do vestibular da UFF em 2005, como esse assunto pode aparecer nas provas:
Assinale a alternativa que apresenta corretamente os conceitos de ligações covalente e iônica, respectivamente.
a) A ligação covalente só ocorre nos compostos orgânicos.
b) A ligação covalente se faz por transferência de elétrons e a ligação iônica pelo compartilhamento de elétrons com spins opostos.
c) A ligação covalente se faz por atração de cargas entre átomos e a ligação iônica por separação de cargas.
d) A ligação covalente se faz por união de átomos em moléculas e a ligação iônica por união de átomos em complexos químicos.
e) A ligação covalente se faz pelo compartilhamento de elétrons e a ligação iônica por transferência de elétrons.
Conforme estudamos até aqui, a ligação covalente se dá pelo compartilhamento de elétrons entre átomos, em compostos orgânicos ou inorgânicos. Já as ligações iônicas ocorrem por meio da transferência de elétrons entre átomos, com a estabilidade proposta na teoria do octeto.
Dessa forma, a alternativa correta para o exercício descrito acima é a letra E.
Ligação química metálica
Por fim, a ligação química que acontece entre dois elementos metálicos é chamada de ligação covalente. Nela, os elétrons estão livres e circulam em um “mar de elétrons” que se forma entre os átomos, como você pode ver no esquema a seguir:
As principais ligas metálicas são formadas a partir desse tipo de ligação. A tabela abaixo exemplifica essa afirmação:
| Liga Metálica | Composição |
| aço comum | Ferro e carbono |
| aço inoxidável | Ferro e cromo (pode conter níquel e carbono) |
| bronze | Cobre e estanho |
| latão | Cobre e zinco |
| ouro 18 quilates | Ouro, prata e cobre |
| amálgama | Mercúrio, prata e ouro |
Os compostos formados por ligações metálicas dessa maneira apresentam como características essenciais:
- Solidez em condição ambiente, de forma que uma exceção é o Mercúrio (Hg), que apresenta-se líquido;
- São dúcteis, ou seja, podem ser transformados em filamentos sem ruptura;
- São maleáveis, podem ser transformados em finas lâminas sem que a estrutura se rompa;
- Visivelmente apresentam brilho;
- Quando tocados emitem um som específico, como de o tilintar de um sino; e
- Conduzem calor e eletricidade em seu mar de elétrons.
Veja a questão sobre ligações químicas abaixo, que caiu na prova da UERJ em 2015. Acompanhe também a resolução proposta pela Coruja.
Para fabricar um dispositivo condutor de eletricidade, uma empresa dispõe dos materiais apresentados na tabela abaixo:
Sabe-se que a condutividade elétrica de um sólido depende do tipo de ligação interatômica existente em sua estrutura. Nos átomos que realizam ligação metálica, os elétrons livres são os responsáveis por essa propriedade. Assim, o material mais eficiente para a fabricação do dispositivo é representado pelo seguinte número:
a) I
b) II
c) III
d) IV
Considerando as propriedades físico-químicas encontradas em cada tipo de ligação, sabemos que a condutividade elétrica se manifesta, principalmente, nos compostos metálicos.
Agora, em uma análise da tabela, percebe-se que o único elemento químico da classe dos metais é o Ferro (Fe), que se associa por meio do “mar de elétrons”. De forma que a alternativa mais adequada é a letra D.
Aprenda mais sobre química com a Coruja!
Você quer aprofundar-se no estudo da química, suas interações orgânicas e inorgânicas? Acompanhe o canal do Estratégia Vestibulares: periodicamente são adicionadas aulas gratuitas que abrangem os conceitos químicos de forma didática e voltada para o estudo pré-prova.
Quer treinar seu conhecimento e não sabe por onde começar? Conheça os simulados gratuitos do Estratégia, tecnicamente montados, esses testes têm o intuito de replicar o momento do vestibular e te preparar didática, física e psicologicamente para o dia da prova. Clique no banner abaixo e conheça!
Veja Também
- Atomística: estrutura e características
- Modelos atômicos: história e evolução
- Partículas subatômicas: principais tipos e características
- Ligações iônicas: o que são, como fazer?
- Geometria molecular: o que é, quais são e exemplos
- Forças intermoleculares: iônica, covalente, metálica, dipolos e hidrogênio
- Polaridade molecular: o que é, como acontece e exercícios
- Propriedades coligativas: o que são, exemplos, conceitos e aplicações
- Distribuição eletrônica: níveis de energia, diagrama e como usar
- Oxirredução: troca de elétrons e balanceamento