Caros alunos, tudo bem? Eu sou o professor Thiago Cardoso, do Estratégia Vestibulares, e escrevo esse artigo para resolver a prova do Vestibular da EsPCEx, ano 2019. A seguir, a resolução e os comentários de cada questão cobrada na prova. Você pode, também, baixar a resolução em PDF.
A prova da ESPCEX 2019 de Química foi dentro do esperado para o concurso e muito bem elaborada. Nenhuma possibilidade de recurso. As questões 35 e 44 foram as mais desafiadoras, porém, o aluno que estudou bastante a matéria tinha plenas condições de fechar esse certame. Clique no link abaixo para receber a prova de Química comentada.
Navegue pelo conteúdo
Prova EsPCEx 2019 corrigida
Questão 33
Quando ocorre a combustão completa de quaisquer hidrocarbonetos, há a produção dos compostos gás carbônico (CO2) e água (H2O). Acerca dessas substâncias afirma-se que:
I – as moléculas CO2 e H2O apresentam a mesma geometria molecular.
II – a temperatura de ebulição da água é maior que a do CO2, pois as moléculas de água na fase líquida se unem por ligação de hidrogênio, interação intermolecular extremamente intensa.
III – a molécula de CO2 é polar e a de água é apolar.
IV – a temperatura de fusão do CO2 é maior que a da água, pois, diferentemente da água, a molécula de CO2 apresenta fortes interações intermoleculares por apresentar geometria angular.
V – o número de oxidação (Nox) do carbono na molécula de CO2 é +4.
Estão corretas apenas as afirmativas
a) I, II e IV.
b) II, III e IV.
c) I, III e V.
d) III e IV.
e) II e V.
Comentários
Vamos analisar as afirmações individualmente.
I – A molécula H2O apresenta dois pares de elétrons não-ligantes no átomo central (oxigênio). Por conta disso, a molécula será angular. Por outro lado, no CO2, não há pares de elétrons não-ligantes no átomo central (carbono), logo a molécula é linear. Afirmação incorreta.
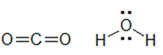
II – Como a água é polar e apresenta hidrogênio ligado a FON, ela forma ligações de hidrogênio. Essas interações intermoleculares são muito mais fortes que as interações dipolo-dipolo, características de substâncias apolares, como o CO2. Afirmação correta.
III – Na verdade, é o contrário. O CO2 é apolar, por ser linear, e a água é polar, por ser angular. Afirmação incorreta.
IV – O mesmo raciocínio para a temperatura de ebulição no item II é válido para a temperatura de fusão. Logo, a temperatura de fusão da água é maior que a do CO2. Afirmação incorreta.
V – Como o oxigênio tem nox -2, o carbono deverá apresentar nox +4. Afirmação correta.
GABARITO: Letra E
Questão 34
Os carbetos pertecem aos chamados compostos de transição, isto é, possuem o elemento carbono, mas, devido às suas características, nos carbetos o carbono forma ânions simples que estabelecem ligações com metais ou semimetais. Os carbetos são compostos que apresentam um dos seguintes ânions: metaneto (C4-) ou acetileto (C22–).
(FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 330)
O carbeto de cálcio (CaC2), também denominado de carbureto ou acetileto de cálcio, é um sólido duro que reage com a água para produção do gás acetileno (C2H2). A reação que se processa é representada pela seguinte equação não balanceada:
CaC2 + H2O → C2H2 + Ca(OH) 2.
Com relação a esta reação, seus reagentes e produtos, são feitas as seguintes afirmativas:
I – o carbeto de cálcio é um composto iônico.
II – a nomenclatura oficial da União Internacional de Química Pura e Aplicada (IUPAC) para o acetileno (C2H2) é etino.
III – o Ca(OH) 2 é classificado como uma base de Arrhenius e tem nomenclatura de hidróxido de cálcio.
IV – a soma dos coeficientes da equação corretamente balanceada é 5.
V – todos os reagentes e produtos são classificados como substâncias simples.
Dado: número atômico (Z) H = 1; O = 8; Ca = 20; C = 6
Estão corretas apenas as afirmativas
a) I, II e V.
b) II, III e IV.
c) I, II, III e IV.
d) II, III, IV e V.
e) I, II, IV e V.
Comentários
Vamos analisar os itens.
I – De fato, é um composto iônico formado pelo íon cálcio (Ca2+) e pelo íon acetileto (C22–). Afirmação correta.
II – O C2H2 apresenta dois carbonos e apresenta ligação tripla. Portanto, é mesmo o etino. Afirmação correta.
III – Exatamente. O hidróxido de cálcio é uma base de Arrhenius, pois libera o íon hidróxido (OH–), quando dissolvida em meio aquoso. Afirmação correta.
IV –Vamos balancear a reação.
CaC2(s) + 2H2O → Ca(OH)2 + C2H2
Portanto, a soma dos coeficientes é:
S = 1 + 2 + 1 + 1 = 5
Afirmação correta.
V – Na verdade, nenhum dos reagentes é uma substância simples. Todos são compostos, pois são formados por mais de um elemento químico. Afirmação errada.
Portanto, estão corretas as afirmações I, II, III e IV.
GABARITO: Letra C
Questão 35
Na ração operacional do Exército Brasileiro, é fornecida uma cartela contendo cinco comprimidos do composto dicloro isocianurato de sódio, também denominado de dicloro-s-triazinotriona de sódio ou trocloseno de sódio, dentre outros. Essa substância possui a função de desinfecção da água, visando a potabilizá-la. Instruções na embalagem informam que se deve adicionar um comprimido para cada 1 L água a ser potabilizada, aguardando-se o tempo de 30 minutos para o consumo. A estrutura do dicloro isocianurato de sódio é representada a seguir:
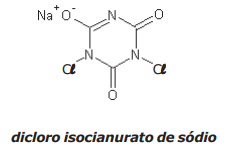
Considerando a estrutura apresentada e o texto, são feitas as seguintes afirmativas:
I – em sua estrutura encontra-se o grupo funcional representativo da função nitrocomposto.
II – todos os carbonos apresentados na estrutura possuem hibridização sp2.
III – sua fórmula molecular é C3Cl2N3NaO3.
IV – Considerando-se um cantil operacional contendo 1000 mL de água, será necessário mais que uma unidade do comprimido para desinfecção completa dessa água
Das afirmativas feitas estão corretas apenas:
a) I e II.
b) III e IV.
c) II e III.
d) I, III e IV.
e) I, II e III.
Comentários
I – Os nitrocompostos são caracterizados pelo grupo funcional –NO2, que não aparece na estrutura do composto em estudo. Afirmação errada.
II – A molécula apresenta três carbonos apontados pela seta azul. Todos eles formam exatamente uma ligação pi. Portanto, todos são sp². Afirmação correta.
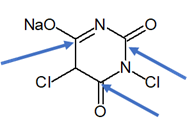
III – Esse é um interessante caso de composto orgânico que não apresenta hidrogênios na sua estrutura. Observe que todos os carbonos já formam 4 ligações, todos os nitrogênios já formam 3 ligações e todos os oxigênios já formam 2 ligações.
Portanto, a fórmula molecular é mesmo a citada: C3Cl2N3NaO3. Afirmação correta.
IV – Pelo enunciado, um comprimido é suficiente para 1 litro, que é a mesma quantidade de água de 1000 mL. Portanto, para 1000 mL, é necessário exatamente um comprimido. Afirmação incorreta.
Logo, apenas II e III estão corretas.
GABARITO: Letra C
Questão 36
A uma solução aquosa de 100 mL de ácido clorídrico (HCl) de concentração 1 mol·L-1 foram adicionados 400 mL de uma solução aquosa de hidróxido de sódio (NaOH) de concentração 0,75 mol·L-1.
Considerando que:
– a solução básica foi parcialmente neutralizada pela solução do ácido;
– o ácido clorídrico é um ácido forte (α=100%);
– o hidróxido de sódio é uma base forte (α=100%).
O pH da mistura resultante dessa reação de neutralização é
Dado: log 4 = 0,60
a) 13,6
b) 11,4
c) 9,8
d) 7,5
e) 4,3
Comentários
Como sabemos, o ácido clorídrico e o hidróxido de sódio reagem completamente por neutralização formando cloreto de sódio.
Para calcular a estequiometria da reação, devemos levar em consideração o número de mols inseridos de cada reagente, o que depende do volume das soluções adicionadas e de sua concentração.
nHCl = [HCl].VHCL = 1.0,100 = 0,100 mol
nNaOH = [NaOH].VNaOH = 0,75.0,400 = 0,300 mol
Montemos agora a tabela estequiométrica da reação.
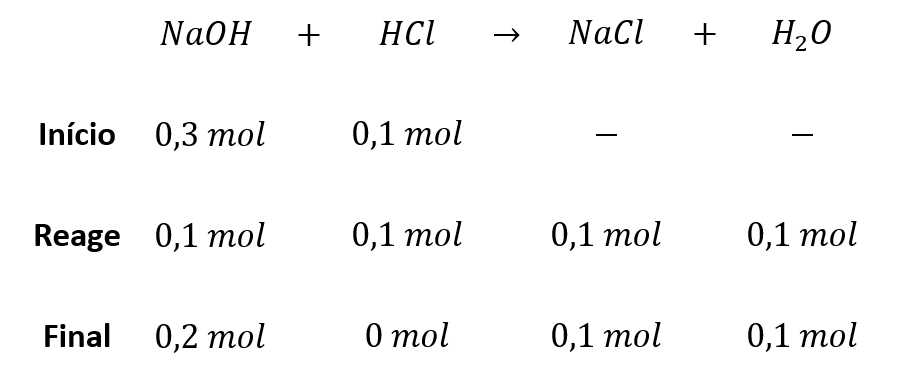
Para calcular a concentração final de íons hidróxido, devemos nos lembrar que houve uma diluição da mistura total, e que o volume passou a ser 500 mL, que é a soma dos volumes das duas soluções separadas.
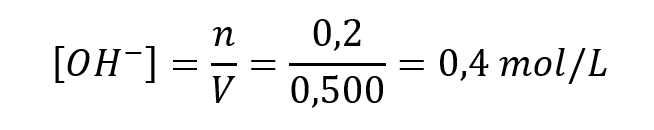
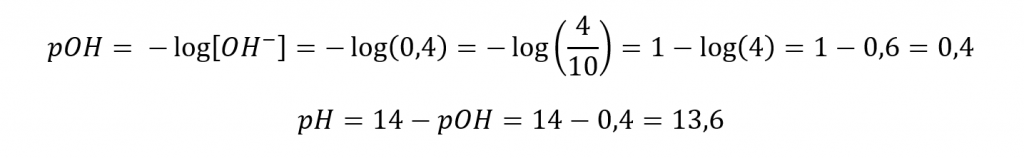
GABARITO: Letra A
Questão 37
Considere as afirmativas acerca dos elementos hipotéticos (A, B, C) apresentados na Tabela Periódica.
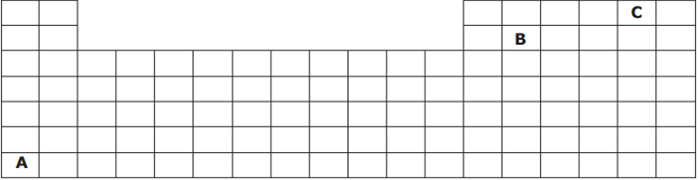
I – Dentre os elementos hipotéticos, o elemento A é o de maior afinidade eletrônica (“energia liberada quando um átomo isolado, no estado gasoso, captura um elétron”).
USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed. Reform – São Paulo: Ed. Saraiva, 2009, pág. 202.
II – Dentre os elementos hipotéticos, pode-se afirmar que o elemento B é o de maior eletropositividade (“capacidade de um átomo perder elétrons, originando cátions”).
USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed. Reform – São Paulo: Ed. Saraiva, 2009, pág. 203.
III – Dentre os elementos hipotéticos, pode-se afirmar que o elemento C é o mais eletronegativo (“força de atração exercida sobre os elétrons de uma ligação”).
USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed. Reform – São Paulo: Ed. Saraiva, 2009, pág. 202.
Das afirmativas feitas está(ão) correta(s) apenas:
a) I.
b) II.
c) III.
d) I e II.
e) II e III.
Comentários
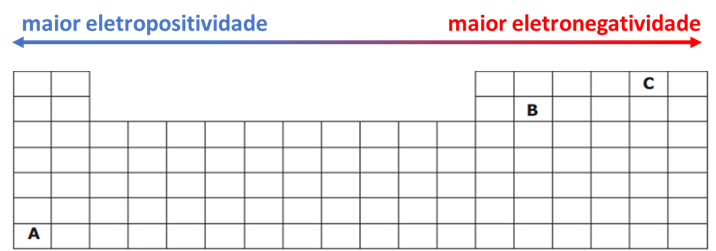
Vejamos o comportamento geral das propriedades desejadas.
Com base nisso, vamos às respostas dos itens pedidos.
I – A afinidade eletrônica tem exatamente essa definição. Ela cresce para a direita, portanto, o elemento A, que é um metal alcalino, é o que possui a menor afinidade eletrônica. Afirmação errada.
II – A eletropositividade cresce para a esquerda, no sentido dos metais alcalinas. Portanto, o elemento A é o mais eletropositivo. Afirmação errada.
III – Como a eletronegatividade cresce para a direita, de fato, O elemento C é o mais eletronegativo. Afirmação correta.
Logo, apenas III está correta.
GABARITO: Letra C
Questão 38
“O tungstênio é encontrado em vários minerais, como óxidos de volframita – (Fe, Mn) WO4, e a scheelita – CaWO4. É usado em filamentos de lâmpadas incandescentes, em tanques de guerra, balas de revólver e em ferramentas de corte e perfuração”.
(FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 207).
Acerca da espécie química CaWO4 e seus átomos constituintes, são feitas as seguintes afirmativas:
I – No composto CaWO4 o número de oxidação (Nox) do tungstênio é +6.
II – O composto CaWO4 é considerado um peróxido.
III – O CaWO4 é uma substância que possui apenas ligações do
tipo covalente.
IV – O tungstênio (Z=74) é um metal de transição externa (“elementos com configuração eletrônica terminando em ns2 (n-1)d1 até 10”).
FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 206Dados: densidade do etanol = 0,8 g/mL
Das afirmativas feitas estão corretas apenas:
a) I e II.
b) II e III.
c) III e IV.
d) I e IV.
e) I, II e III.
Comentários
Vamos analisar as afirmações pedidas.
I – Sendo +2 o nox do cálcio e -2 o nox do oxigênio, temos que:
+2 + x + 4.(-2) = 0
x = 8 – 2 = 6
Portanto, o nox é mesmo igual a +6. Afirmação correta.
II – O composto CaWO4 não pode ser um óxido, porque não é um composto binário. Na verdade, trata-se de um sal formado pelo cátion Ca2+ e pelo ânion WO42–. Afirmação errada.
III – Trata-se de um composto iônico. Afirmação errada.
IV – Nesse item, o aluno terá um trabalho. Mas facilitaria muito lembrar dos números atômicos dos gases nobres.
He – 2
Ne – 10
Ar – 18
Kr – 36
Xe – 54
Como o tungstênio tem número atômico igual a 74, ele tem a eletrosfera do xenônio mais 20 elétrons.
Portanto, ele termina em 5d4, logo, é um metal de transição externa, como afirmado pelo enunciado. Vale lembrar que essa é uma denominação muito pouco usada.
As afirmações I e IV são, portanto, as únicas corretas.
W : [Xe]4f145d46s2
GABARITO: Letra D
Questão 39
Acidulantes são substâncias utilizadas principalmente para intensificar o gosto ácido de bebidas e outros alimentos. Diversos são os ácidos empregados para essa finalidade. Alguns podem ser classificados como ácidos orgânicos e outros como ácidos inorgânicos. Dentre eles, estão os quatro descritos pelas fórmulas moleculares e estruturais abaixo.

a) 1 – Ácido etânico; 2 – Ácido fenóico; 3 – Ácido fosfórico; 4 – Ácido bórico.
b) 1 – Ácido etanóico; 2 – Ácido benzóico; 3 – Ácido fosfórico; 4 – Ácido bórico.
c) 1 – Ácido etanóico; 2 – Ácido benzílico; 3 – Ácido fosforoso; 4 – Ácido borático.
d) 1 – Ácido propílico; 2 – Ácido benzílico; 3 – Ácido fosfático; 4 – Ácido boroso.
e) 1 – Ácido etanoso; 2 – Ácido benzóico; 3 – Ácido fosforoso; 4 – Ácido bárico.
Comentários
A nomenclatura dos ácidos carboxílicos utiliza o sufixo –óico.
Como o composto (1) apresenta dois carbonos, ele é o ácido etanoico. O composto (2), por sua vez, é o ácido benzóico. Nos ácidos inorgânicos, o H3PO4 é o ácido mais oxigenado do fósforo. Portanto, ele é o ácido fosfórico. Para fins de revisão, vejamos os nomes dos ácidos do fósforo.
H3PO2 – Ácido hipofosforoso
H3PO3 – Ácido fosforoso
H3PO4 – Ácido fosfórico
O boro só forma um único ácido (H3BO3), portanto, ele recebe o sufixo –ico. Logo, é o ácido bórico.
GABARITO: Letra B
Questão 40
“As reações químicas ocorrem sempre em uma proporção constante, que corresponde ao número de mol indicado pelos coeficientes da equação química. Se uma das substâncias que participa da reação estiver em quantidade maior que a proporção correta, ela não será consumida totalmente. Essa quantidade de substância que não reage é chamada excesso (…). O reagente que é consumido totalmente, e por esse motivo determina o fim da reação, é chamado de reagente limitante.” (USBERCO, João e SALVADOR, Edgard. Química, Vol. 1: Química Geral. 14ª ed. Reform – São Paulo: Ed. Saraiva, 2009, pág. 517)
Um analista precisava neutralizar uma certa quantidade de ácido sulfúrico (H2SO4) de seu laboratório e tinha hidróxido de sódio (NaOH) à disposição para essa neutralização. Ele realizou a mistura de 245 g de ácido sulfúrico com 100 g de hidróxido de sódio e verificou que a massa de um dos reagentes não foi completamente consumida nessa reação. Sabendo-se que o reagente limitante foi completamente consumido, a massa do reagente que sobrou como excesso após a reação de neutralização foi de:
Dado: massa atômica do H= 1 u; O= 16 u; Na= 23 u; Cl=35,5 u
a) 52,4 g
b) 230,2 g
c) 384,7 g
d) 122,5 g
e) 77,3 g
Comentários
Primeiramente, vamos calcular o número de mols presentes de cada uma das espécies químicas no ambiente reacional. Para isso, precisaremos das massas molares.
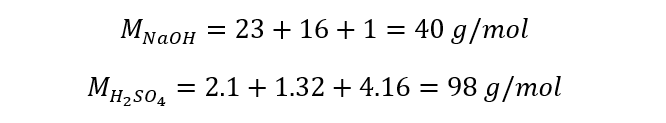
Agora, basta dividir as massas pelas massas molares.
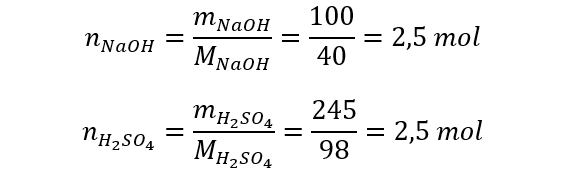
O próximo passo é escrever a equação balanceada, notando que o ácido sulfúrico é um diácido. Portanto, haverá a proporção molar 2:1 na reação entre NaOH e H2SO4.
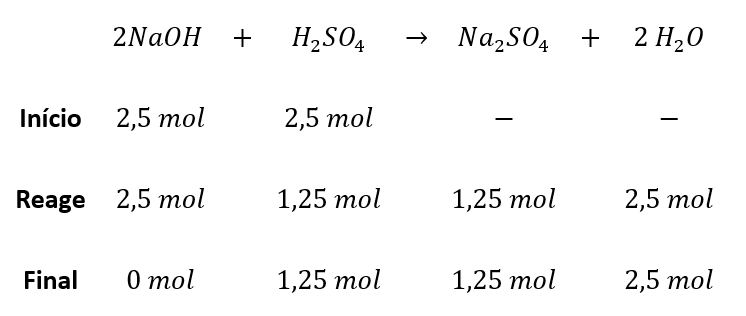
Portanto, o hidróxido de sódio é o reagente limitamente e o ácido sulfúrico é o reagente em excesso. A massa restante é:
mH2SO4 = nH2SO4 . MH2SO4 = 1,25.98 = 122,5 g
GABARITO: Letra D
Questão 41
No ano de 2018, os alunos da EsPCEx realizaram, na aula prática de laboratório de química, um estudo sobre revestimento de materiais por meio da eletrólise com eletrodos ativos, visando ao aprendizado de métodos de proteção contra corrosão. Nesse estudo, eles efetuaram, numa cuba eletrolítica, o cobreamento de um prego, utilizando uma solução de sulfato de cobre II e um fio de cobre puro como contra-eletrodo. Para isso, utilizaram uma bateria como fonte externa de energia, com uma corrente contínua de intensidade constante de 100 mA e gastaram o tempo de 2 minutos. Considerando-se não haver interferências no experimento, a massa aproximada de cobre metálico depositada sobre o prego foi de:
Dados: massa molar do cobre = 64 g · mol-1 ; 1 Faraday = 96500 C · mol-1
a) 6,50 mg
b) 0,14 mg
c) 20,42 mg
d) 12,01 mg
e) 3,98 mg
Comentários
O primeiro ponto a notar é que o cobre absorve 2 elétrons.
Cu2+(aq) + 2e– → Cu(s)
Portanto, a produção de 1 mol de cobre metálico requer o consumo de 2 mols de elétrons (ou uma carga de 2.96500 C).
No experimento, a carga fornecida pode ser obtida pelo produto entre a corrente e o tempo de produção, que precisa ser convertido para segundos.
Q = It = 0,100.2.60 = 12 C
O número de mols de cobre produzidos na eletrólise pode ser obtido como a razão entre a carga que, de fato, atravessou o fio pela quantidade de carga necessária para produzir 1 mol.
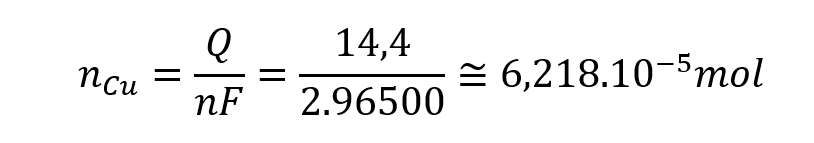
Para obter a massa, basta multiplicar o resultado do item anterior pela massa molar do elemento, que foi fornecida no enunciado.
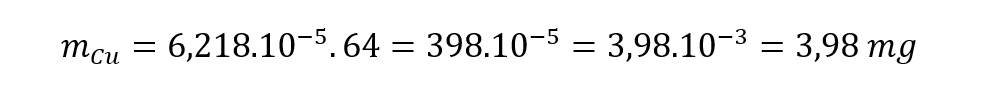
GABARITO: Letra E
Questão 42
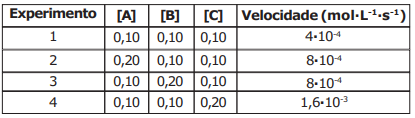
O estudo da velocidade das reações é muito importante para as indústrias químicas, pois conhecê-la permite a proposição de mecanismos para uma maior produção. A tabela abaixo apresenta os resultados experimentais obtidos para um estudo cinético de uma reação química genérica elementar.
αA + βB + γC → D + E
A partir dos resultados experimentais apresentados na tabela, pode se afirmar que a expressão da equação da lei da velocidade (V) para essa reação química é:
a) V=k[A]1[B]1[C]2
b) V=k[A]2[B]1[C]2
c) V=k[A]2[B]2[C]1
d) V=k[A]1[B]1[C]1
e) V=k[A]0[B]1[C]1
Comentários
Para calcular a lei de velocidade, devemos notar que:
- Entre os experimentos 1 e 2, a concentração de [A] duplicou, enquanto os demais permaneceram constantes. Nisso, a velocidade de reação também duplicou. Portanto a velocidade é diretamente proporcional à concentração de [A]. Logo, o expoente de [A] é igual a 1;
- Entre os experimentos 1 e 3, a concentração de [B] duplicou, enquanto os demais permaneceram constantes. Nisso, a velocidade de reação também duplicou. Portanto, a velocidade é diretamente proporcional à concentração de [B]. Logo, o expoente de [B] é igual a 1;
- Entre os experimentos 1 e 4, a concentração de [C] duplicou, enquanto os demais permaneceram constantes. Nisso, a velocidade de reação quadruplicou. Podemos calcular a ordem de reação:
2c = 4 ؞ c = 2
Portanto, a ordem de reação em relação a C é igual a 2.
Logo, a lei de velocidade é:
v = k[A][B][C]2
GABARITO: Letra A
Questão 43
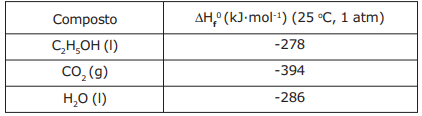
A reação de combustão completa do etanol (C2H5OH) produz gás carbônico (CO2) e água (H2O). Dada a tabela abaixo, de calores de formação das espécies químicas, e considerando a reação de combustão completa desse álcool, são feitas as seguintes afirmativas:
I – O agente oxidante dessa reação é o O2.
II – O coeficiente estequiométrico da água, após o balanceamento da equação, é 2.
III – Considerando a densidade do etanol 0,8 g/mL (25 ºC; 1 atm), a combustão completa de 1150 mL desse composto libera aproximadamente 27360 kJ.
IV – A quantidade de calor liberada na combustão de 1 mol de etanol é de 278 kJ·mol-1.
Das afirmativas feitas estão corretas apenas:
a) II, III e IV.
b) I e II.
c) III e IV.
d) II e IV.
e) I e III.
Comentários
Vamos escrever a reação de combustão do etanol, notando que sua fórmula molecular é C2H6O.
C2H6O + O2 → CO2 + H2O
Podemos balancear a reação, notando que, do lado esquerdo, há dois carbonos, portanto, precisamos de 2 CO2 do lado direito. Analogamente, do lado esquerdo há 6 hidrogênios, portanto, precisamos de 3 H2O do lado direito para balancear.
C2H6O + O2 → 2 CO2 + 3 H2O
Na reação balanceada, encontramos 7 átomos de oxigênio no lado direito. Como já temos um no etanol, precisamos de 3 O2 para balancear.
C2H6O + 3 O2 → 2 CO2 + 3 H2O
Vamos analisar agora as afirmações.
I – As combustões são essencialmente reações de oxidação, em que o oxigênio é o agente oxidante (ou comburente). Já o etanol é oxidado a dióxido de carbono. Note que o nox do carbono passa de -2 para +4. Afirmação correta.
II – Como vimos, o coeficiente estequiométrico da água é igual a 3. Afirmação errada.
III – Precisamos calcular o calor de combustão molar.
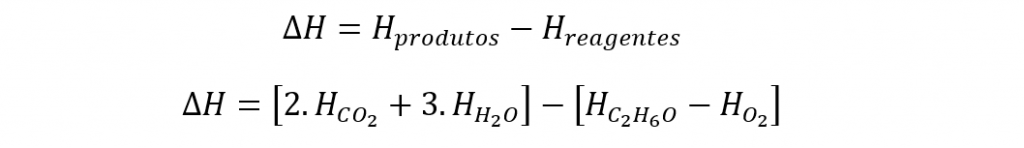
O oxigênio tem entalpia nula, por ser uma substância simples no estado padrão e na forma alotrópica mais estável. As demais entalpias de formação foram fornecidas.
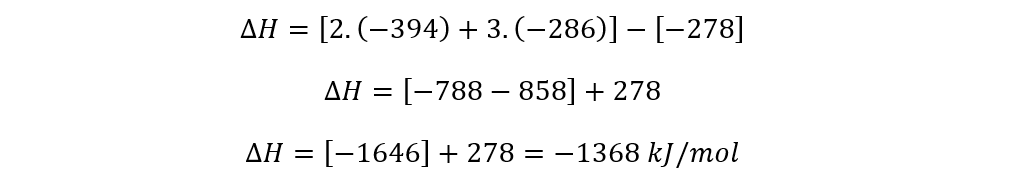
Agora, precisamos calcular a quantidade de mols de etanol presentes no volume fornecido de 1150 mL. Para isso, primeiramente vamos calcular a massa correspondente a esse volume a partir da densidade.
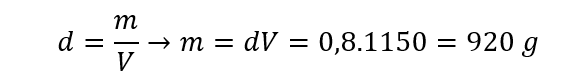
Para calcular o número de mols a partir da massa, precisamos da massa molar do composto.
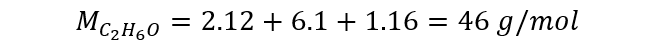
Agora, façamos o cálculo do número de mols.
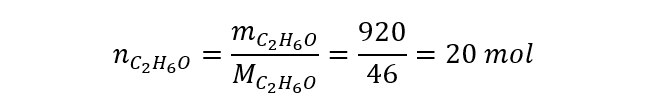
Já calculamos o calor de combustão para 1 mol. Agora, ficou fácil calcular para 20 mols.
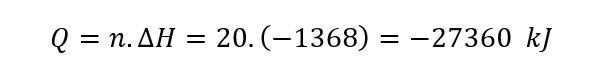
Afirmação correta.
IV – Como vimos no item anterior, o calor de combustão molar é de aproximadamente 1368 kJ/mol. Afirmação errada.
Portanto, as afirmações I e III estão corretas.
GABARITO: Letra E
Questão 44
Considere que a reação de cobre metálico com ácido nítrico diluído produz, nas CNTP, um volume gasoso de 181,6 L de óxido de nitrogênio II (NO), água e nitrato de cobre II. Nesse caso, a soma dos coeficientes estequiométricos da equação corretamente balanceada dessa reação completa e a massa de cobre consumida são, respectivamente:
Dados: massa atômica de cobre 64 u; volume molar nas CNTP: 22,7 L
a) 18 e 1222 g.
b) 20 e 768 g.
c) 16 e 154 g.
d) 20 e 650 g.
e) 18 e 402 g.
Questão de balanceamento bem interessante. Pelas informações do enunciado, temos que a reação desbalanceada é.
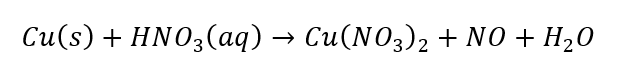
Notemos que o cobre se oxida enquanto o nitrogênio do ácido nítrico se reduz.
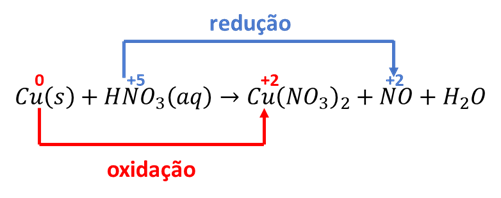
Porém, observe que não são todos os nitrogênios presentes no ácido nítrico que se reduzem. Mas, apenas, os que vão parar na forma de NO.
Vamos associar coeficientes genéricos aos participantes da reação.
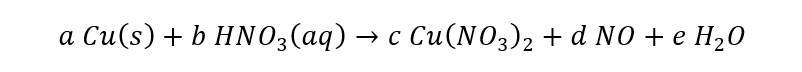
Devemos usar o princípio de que o número de elétrons ganhos pelo nitrogênio é igual ao número de elétrons perdidos pelo cobre. Para isso, note que somente os nitrogênios do NO (d) ganham 3 elétrons.
3d = 2a
Façamos d = 2, a = 3.
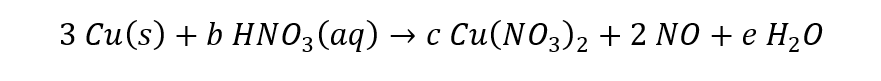
Podemos igualar o número de mols de cobre.
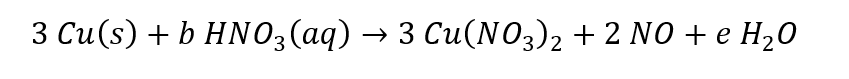
No lado esquerdo, temos 8 átomos de nitrogênio. Portanto, precisamos de 8 átomos no lado esquerdo.
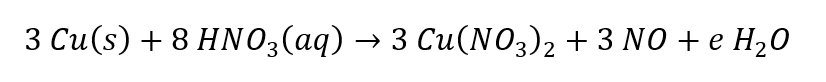
Para finalizar, precisamos de 4 H2O do lado direito para balancear os hidrogênios.
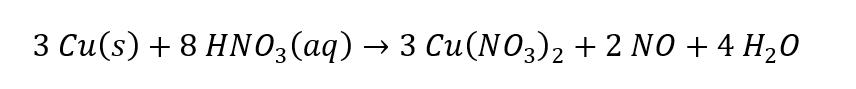
Podemos conferir o oxigênio de ambos os lados. No lado esquerdo, temos 24 átomos. Do lado direito também (18 no nitrato de cobre, 2 no óxido de nitrogênio e 4 na água). Portanto, a soma dos coeficientes da equação balanceada é igual a:
S = 3 + 8 + 3 + 2 + 4 = 20
Podemos calcular também o número de mols de óxido de nitrogênio produzidos na reação. Sabemos que o volume de 1 mol é igual a 22,7 L. Como foram produzidos 181,6 L, temos que o número de mols do óxido é:
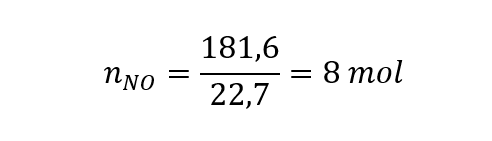
O número de mols de cobre consumidos segue a proporção estequiométrica.
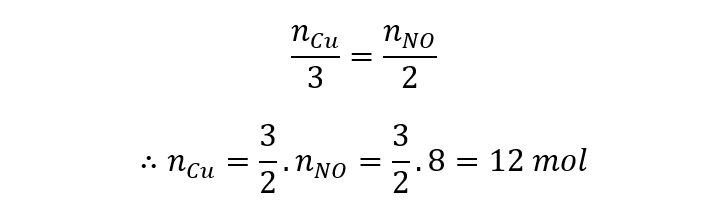
Para calcular a massa de cobre, basta multiplicar pela massa molar, que foi fornecida no enunciado.
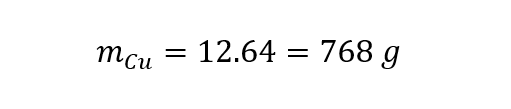
GABARITO: Letra B



