Tudo bem meus queridos? Prof. Prazeres na área para comentar e resolver as questões da prova de Química da 2ª Fase do Vestibular da UNESP 2020. Foram três questões. Vamos nessa?
2ª Fase UNESP 2020 – Química
Questão 16
Em quatro tubos de ensaio contendo iguais volumes de soluções aquosas ácidas de HCl com mesma concentração em mol/L, foram acrescentadas iguais quantidades, em mol, de quatro substâncias diferentes, sob forma de pó, como ilustra a imagem.
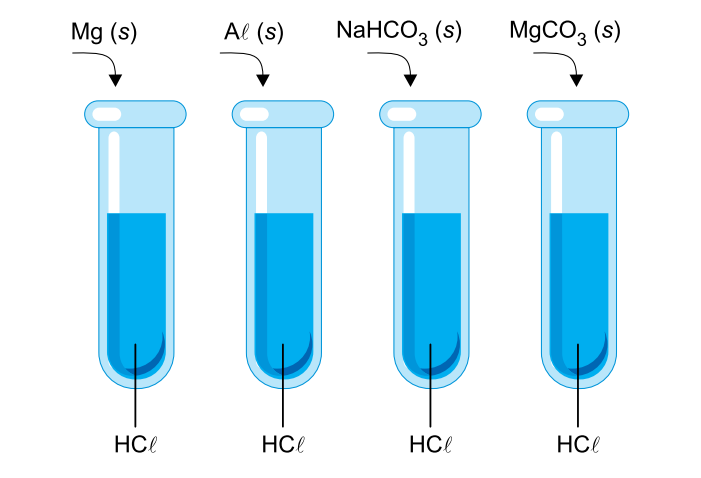
Em cada tubo houve reação química, evidenciada pela produção de gás e pelo desaparecimento total do sólido.
a) Classifique as substâncias sólidas acrescentadas aos tubos de ensaio de acordo com os seguintes critérios:
- aquelas que são boas condutoras de eletricidade.
- aquelas que apresentam ligações covalentes.
b) Em qual dos tubos houve produção de maior volume de gás? Justifique sua resposta.
Gabarito comentado
a) As substâncias sólidas que foram adicionadas são classificadas em dois tipos: metálicas e iônicas. As substâncias metálicas apresentam elétrons deslocalizados, portanto, são excelentes condutores de eletricidade.
Os materiais iônicos apresentam cátions e ânions presos em uma estrutura organizada, logo, são péssimos condutores de eletricidade no estado sólido. Assim, os materiais que são bons condutores de eletricidade são: Mg (s) ou magnésio e Al (s) ou alumínio.
As ligações covalentes estão presentes nos ânions dos compostos iônicos: HCO3– e CO32-, conforme mostrado abaixo:

Assim, as substâncias que apresentam ligações covalentes são: NaHCO3 e MgCO3.
b) Conforme o texto, todos os tubos foram colocadas as mesmas quantidades, em mol, do ácido clorídrico e dos reagentes, portanto, analisa-se as equações de reação para cada mol de reagente consumido e suas respectivas quantidade de gases formadas:
Assim, percebe-se que o reagente que apresenta maior número de mols gasosos produzido é o alumínio sólido. Sabendo que, as reações operaram nas mesmas condições de temperatura e pressão, a reação de o maior produção partículas gasosas, também desprende o maior volume de gás.
Resposta discursiva
a) Os materiais que são bons condutores de eletricidade são: Mg (s) ou magnésio e Al (s) ou alumínio.
As substâncias que apresentam ligações covalentes são: NaHCO3 e MgCO3.
b) Para um mesmo número de mols dos reagentes, tem-se:
Assim, percebe-se que o reagente que apresenta maior número de mols gasosos produzido é o alumínio sólido. Sabendo que, as reações operaram nas mesmas condições de temperatura e pressão, a reação de o maior produção partículas gasosas, também desprende o maior volume de gás.
Questão 17
Parte das areias das praias do litoral sul do Espírito Santo é conhecida pelos depósitos minerais contendo radioisótopos na estrutura cristalina. A inspeção visual, por meio de lupa, de amostras dessas areias revela serem constituídas basicamente de misturas de duas frações: uma, em maior quantidade, com grãos irregulares variando de amarelo escuro a translúcido, que podem ser atribuídos à ocorrência de quartzo, silicatos agregados e monazitas; e outra, com grãos bem mais escuros, facilmente atraídos por um ímã, contendo óxidos de ferro magnéticos associados a minerais não magnéticos.
As fórmulas químicas das monazitas presentes nessas areias foram estimadas a partir dos teores elementares de terras raras e tório e são compatíveis com a fórmula
(Flávia dos Santos Coelho et al. “Óxidos de ferro e monazita de areias de praias do Espírito Santo”. Química Nova, vol. 28, no 2, março/abril de 2005. Adaptado.)
a) Qual o nome do processo de separação de misturas utilizado para separar as partes escuras das claras da areia monazítica? Com base na fórmula química apresentada, demonstre que a monazita é eletricamente neutra.
b) O principal responsável pela radioatividade da areia monazítica é o tório-232, um emissor de partículas alfa. Escreva a
equação que representa essa emissão e calcule o número de nêutrons do nuclídeo formado.
Gabarito Comentado
a) Segundo o texto, as porções incolor e escura podem ser separadas por ímã, assim, o método sugerido para a separação é atração magnética ou separação magnética.
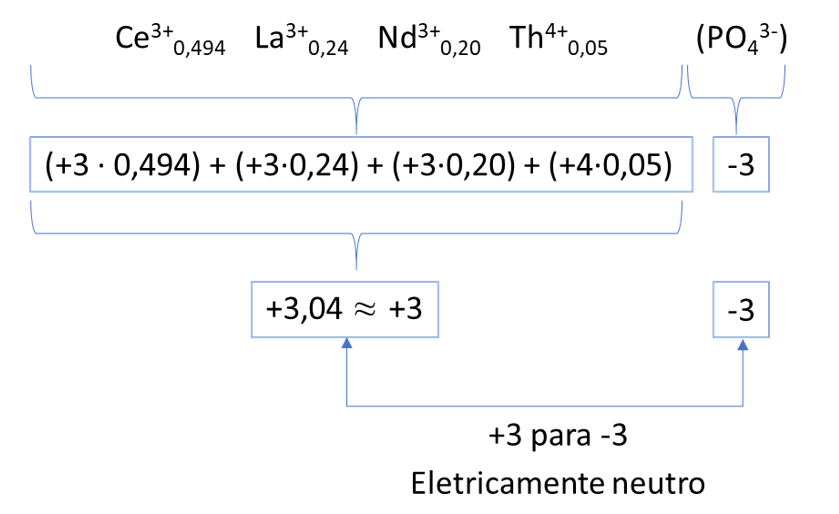
ou
O número de nêutrons do elemento formado é calculado por:
A = Z + n
228 = 88 + n
n = 140 nêutrons
Resposta discursiva
a) O método indicado é atração magnética ou separação magnética.
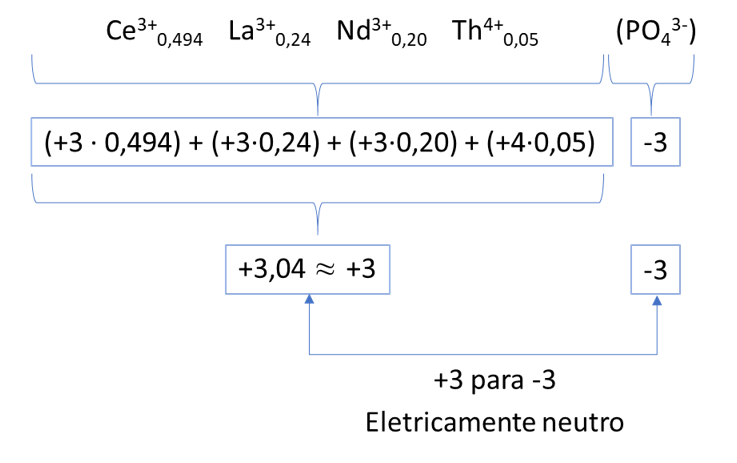
ou
O número de nêutrons do elemento formado é calculado por:
A = Z + n
228 = 88 + n
n = 140 nêutrons
Questão 18
A melatonina (massa molar = 232 g/mol) é um hormônio produzido pela glândula pineal, conhecido como “hormônio da escuridão” ou “hormônio do sono”. A biossíntese desse hormônio se dá a partir do triptofano, que se transforma em serotonina, e esta em melatonina. Essas transformações ocorrem por ação de enzimas.
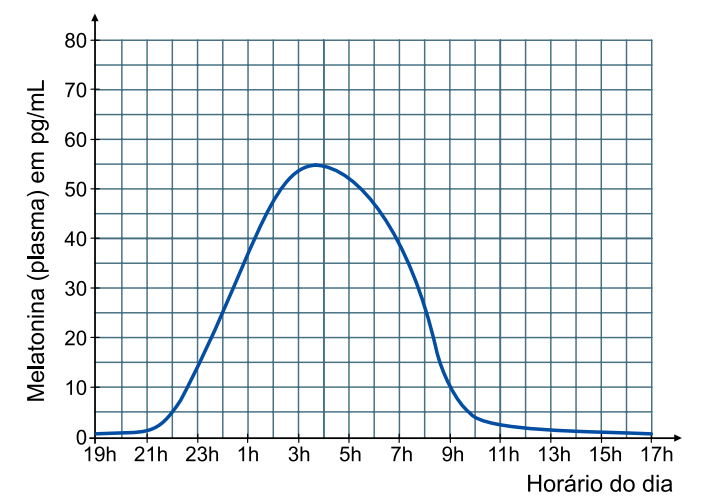
A produção diária de melatonina no organismo humano tem um ritmo sincronizado com o ciclo de iluminação ambiental característico do dia e da noite, de modo que o pico de produção ocorre durante a noite. O gráfico ilustra a concentração de melatonina no plasma, em diferentes horários do dia e da noite.
a) Identifique na fórmula do triptofano, reproduzida no campo de Resolução e Resposta, o átomo de carbono quiral e a função amina primária. Considerando a sequência da biossíntese da melatonina, identifique em qual transformação ocorre descarboxilação.
b) Considerando o gráfico e sabendo que , calcule a quantidade em mol e o número de moléculas de melatonina presentes em cada mL de plasma humano às 8 horas da manhã.
Gabarito Comentado
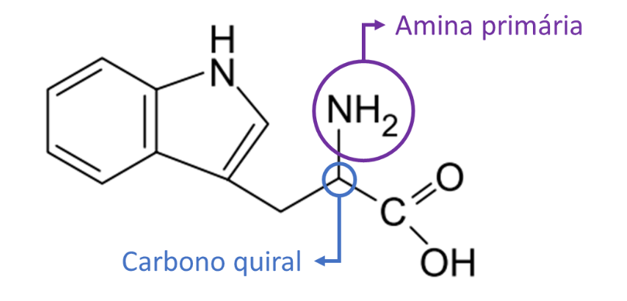
A etapa da reação que ocorre uma reação de eliminação da carboxila (-COOH), ou seja, a descarboxilação é a transformação do triptofano em serotonina.
b) As 8h da manhã, a concentração de melatonina no plasma é de 25 pg/mL = 25·10-12 g por ml. Sabendo que a fórmula molecular da melatonina é igual a C13H16N2O7 e sua massa molar é igual a 232 g/mol, calculam-se:

Gabarito Comentado
A descarboxilação é a transformação do triptofano em serotonina.
b) As 8h da manhã, a concentração de melatonina no plasma é de 25 pg/mL = 25·10-12 g por ml.
Sabendo que a fórmula molecular da melatonina é igual a C13H16N2O7 e sua massa molar é igual a 232 g/mol, calculam-se:

É isso, pessoal! Esse é o gabarito da prova da 2ª Fase do vestibular da UNESP 2020. Você também pode baixar gratuitamente no arquivo a seguir. Sigam-me nas redes sociais. Têm muitas dicas lá. Mande uma mensagem, caso tenha tido alguma dúvida. Abraços!
Instagram: @professorprazeres