Olá, vestibulando! Tudo bem com você? Este artigo foi feito para você que está se preparando para gabaritar todas as questões do vestibular. Então, seja bem-vindo a mais uma dica de química! Aqui, o objetivo é analisar os principais pontos das temáticas que mais caem no Vestibular. Dessa vez, o Estratégia Vestibulares aborda o que você precisa saber sobre os Estados da Matéria e suas Transformações. Então, vamos nessa!
Navegue pelo conteúdo
Os Estados Físicos da Matéria
A matéria é formada por pequenas partículas denominadas átomos e moléculas. Dependendo da proximidade das partículas que a constitui, é possível determinar o estado de agregação, ou seja, o estado físico da matéria. Veja abaixo quais são os principais:
- Sólido
- Líquido
- Gasoso
Embora existam outros estados físicos da matéria, eles são estudados apenas em níveis mais avançados. Para o seu vestibular, preste mais atenção aos mais clássicos.
A água é um dos raros materiais no nosso planeta que pode ser encontrado nos três estados. Por isso, vamos usá-la para exemplificar alguns aspectos mais específicos desse assunto. Na tabela abaixo, note as características de forma e volume em cada estado físico da água. Lembre-se que forma e volume são propriedades macroscópicas da matéria.
| Fases da Matéria | Forma | Volume |
 Sólido Sólido | FIXA/CONSTANTE/INVARIÁVEL Maior Rigidez | CONSTANTE |
 Líquido Líquido | VARIÁVEL Não tem a rigidez dos sólidos | CONSTANTE |
 Gasoso Gasoso | VARIÁVEL | VARIÁVEL |
No estado sólido, as moléculas ficam muito próximas umas das outras. Já no estado líquido, a matéria é, no geral, constituída de partículas mais afastadas. Por isso, corpos líquidos se movimentam de forma mais fluida. O estado gasoso é o que tem o maior distanciamento médio entre as partículas em condições ambiente e, portanto, é o que tem maior movimentação, ou grau de liberdade.
Como podemos ver na imagem, quanto mais agrupadas estiverem as partículas, maior a possibilidade da matéria estar no estado sólido. Da mesma forma, quanto mais distantes e desorganizadas as partículas estiverem, maior a tendência da matéria estar no estado gasoso. Essa dinâmica depende de quatro fatores: Pressão, Temperatura, Velocidade e Forças.
As Forças que atuam sobre a matéria podem ser de coesão ou repulsão. Ambas são consideradas propriedades microscópicas da matéria. A força de coesão faz com que as moléculas se aproximem uma das outras, por consequência é a força predominante no estado sólido. Já a força de repulsão faz com que as partículas se afastem umas das outras e permaneçam no estado gasoso.
O fator velocidade diz respeito à energia cinética média das partículas, ou seja, a velocidade de movimento. No estado gasoso, a energia cinética é maior. Com a alta velocidade, as moléculas colidem e se afastam, de modo que ocupam um espaço maior. Por isso, neste estado, a forma e o volume são variáveis. No caso da fase sólida, como as moléculas estão muito próximas uma das outras, a energia cinética média é baixa.
Com essa explicação geral, procure identificar, no exercício abaixo, em qual estado físico cada matéria se encontra:
Exercício de Fixação sobre os estados da matéria
Coloque (S) para sólido, (L) para líquido ou (G) para gasoso:
( ) Suco
( ) Vapor
( ) Gás hélio
( ) Suor
( ) Água do mar
( ) Álcool
( ) Gelo
( ) Neblina
( ) Tinta
( ) Giz
Resolução
(L) Suco
(G) Vapor
(G) Gás hélio
(L) Suor
(L) Água do mar
(L) Álcool
(S) Gelo
(G) Neblina
(L) Tinta
(S) Giz
Mudanças de estado da matéria
Uma substância química pode se transformar de um estado físico para outro. Para entender, observe o esquema a seguir:
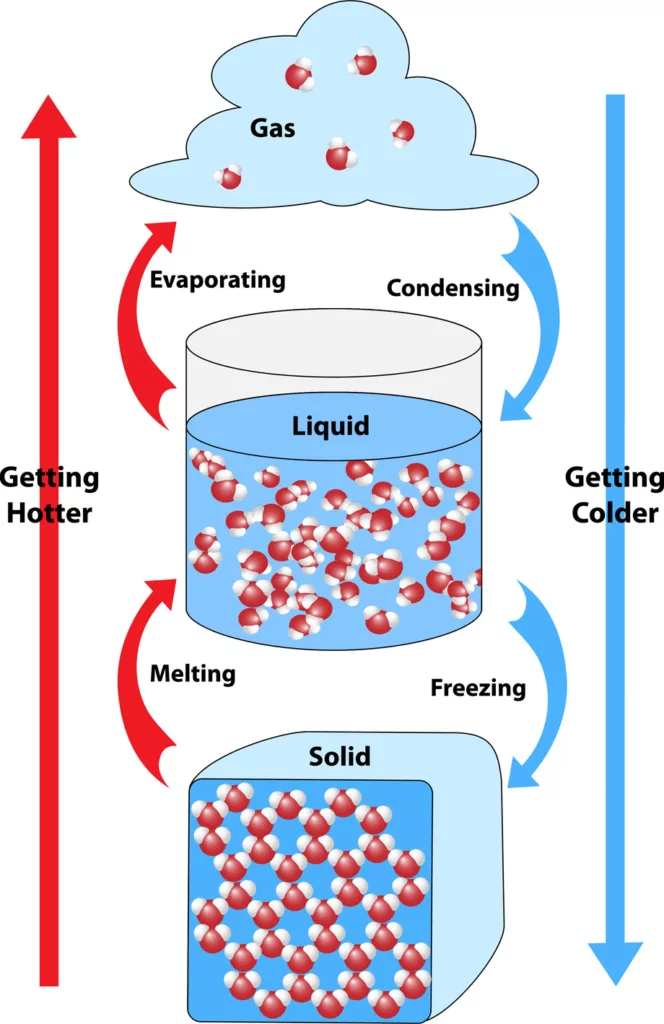
Cada processo de mudança de estado recebe um nome diferente. São eles: Fusão, Solidificação, Vaporização, Condensação e Sublimação.
Fusão: é a mudança ocasionada pelo aquecimento de uma substância no estado sólido até o estado líquido. O fornecimento de energia ao sistema gera um aumento da temperatura, de tal forma que a matéria alcance o seu ponto de fusão. Exemplo: derretimento do gelo.
Solidificação: é a passagem do estado líquido para o estado sólido. Acontece por resfriamento (ou arrefecimento) do sistema. A temperatura tende a diminuir até atingir o ponto de congelamento da substância. Exemplo: formação de geleiras.
Vaporização: é a alteração do estado líquido para o estado gasoso por meio do aquecimento. Esse processo subdivide-se em:
- Evaporação: é quando a transformação do estado físico é muito lenta. Exemplo: roupa molhada secando no varal ou evaporação de rios.
- Ebulição: é quando a transformação do estado físico ocorre à temperatura de ebulição, que é uma característica específica de cada matéria. A mudança é acompanhada da formação de bolhas. Exemplo: fervura da água.
- Calefação: consiste na mudança de estado de forma imediata, ou seja, quando o líquido entra em contato com uma superfície aquecida acima de seu ponto de ebulição. Exemplo: pingo de água sobre um ferro quente ou água caindo sobre uma chapa metálica muito quente.
“O ponto de ebulição, também chamado de temperatura de ebulição, é a temperatura na qual uma substância se transforma do estado líquido para o estado gasoso.”
Liquefação/Condensação: A liquefação é a passagem do gás para o estado líquido. Já a condensação é a transformação do vapor para o estado líquido. Então, liquefação e condensação não são sinônimos. É necessário, em ambas, diminuir a temperatura para que ocorra a mudança de estado físico. Porém, na liquefação é preciso diminuir a temperatura e aumentar a pressão, simultaneamente. Ao passo que, para ocorrer a condensação, é preciso aumentar a pressão ou diminuir a temperatura, separadamente.
Um exemplo de liquefação é quando a água é aquecida e seu vapor entra em contato com a tampa da panela que, por apresentar uma temperatura mais baixa, acumula água em sua superfície. Já na condensação, um exemplo clássico é o gás de cozinha. Atente-se para não confundir gás com vapor (GÁS é diferente de VAPOR). O vapor é o estado momentâneo que uma substância líquida assume, como, por exemplo, o vapor d’ água. Já o gás é toda substância que se encontra no estado gasoso permanente, tais como: os gases oxigênio, nitrogênio e carbono.
Sublimação: é quando o estado sólido passa direto para a estado gasoso por meio de aquecimento ou, de forma oposta, quando o estado gasoso passa para o sólido por resfriamento. Exemplos: naftalina e gelo seco.
Outro ponto cobrado nas provas de vestibulares são os processos endotérmicos e exotérmicos. Eles estão presentes tanto em transformações químicas, as reações, quanto em mudanças de estados físicos. Nos processos exotérmicos, o meio é aquecido e o sistema perde calor. Já nos processos endotérmicos, o sistema tende a ganhar calor e o meio resfria-se.
Levando-se em consideração esses aspectos, podemos concluir que a solidificação e a condensação são processos exotérmicos. A fusão, a vaporização e a sublimação, por outro lado, são processos endotérmicos.
Estados da Matéria no Vestibular
| CAI NA PROVA |
| 1. (SEDUC –2016) A imagem abaixo representa o modelo cinético molecular dos diferentes estados de agregação das moléculas da água. |
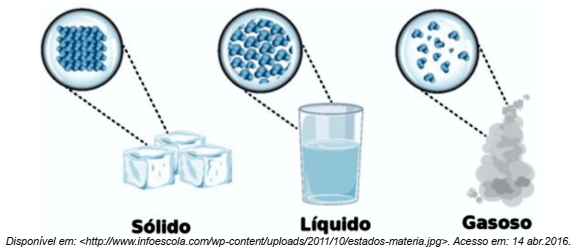
De acordo com esse modelo, no estado físico sólido, as moléculas estão:
a) Agitadas
b) Distantes
c) Espessas
d) Livres
e) Organizadas
Comentários: As moléculas do estado gasoso estão dispersas, distantes e desorganizadas. Isso porque as moléculas estão mais agitadas e ocupam um volume maior. Já as moléculas do estado sólido ficam muito próximas uma das outras e, consequentemente, bem organizadas. Gabarito E.
2. (SEDUCE–2010) Segundo André Guinier (1999), a matéria é constituída por partículas de base do modelo. Um conjunto dessas partículas (átomos ou moléculas) caracteriza a matéria, que, de acordo com o autor, se apresenta em apenas dois estados: ordenado e desordenado. Considerando essas ideias e como as moléculas se comportam em termos de distância intermolecular, pode-se dizer que os estados sólido, líquido e o gasoso são, respectivamente:
a. ordenado, desordenado e ordenado.
b. desordenado, ordenado e ordenado.
c. ordenado, desordenado e ordenado.
d. desordenado, desordenado e ordenado.
Comentários: em regra, no estado sólido o volume é constante, logo as moléculas estão ordenadas. Como na fase líquida e gasosa as partículas formam um volume variável, podemos concluir que a distância intermolecular entre elas é desordenadas. Gabarito C.
3. (UFMT – 2017) Um fenômeno interessante pode ocorrer quando pequenas gotas de um líquido são submetidas a um aquecimento intenso e repentino. Por exemplo, ao pingar gotas de água sobre uma chapa muito quente, o líquido é imediatamente aquecido, formando-se uma camada de vapor entre cada gota e a chapa. Então as gotas deslizam sobre a chapa e emitem um ruído característico enquanto vaporizam. Esse fenômeno de mudança de estado físico é chamado:
a) Evaporação.
b) Vaporização.
c) Calefação.
d) Sublimação
Comentários: Calefação consiste na mudança de estado muito rápido, de forma imediata, ou seja, quando o líquido se aproxima de uma superfície bem quente. É instantânea a mudança de estado. Gabarito C.
a) A alternativa “a” está incorreta. Na evaporação, a transformação é muito lenta.
b) A alternativa “b” está errada. Vaporização engloba a evaporação, calefação e ebulição. Está muito abrangente.
c) É o gabarito.
d) A alternativa “d” está errada. Sublimação é a mudança do sólido para o gasoso ou vice-versa. O líquido não faz parte do processo.
4. (IF –BA– 2014) Nos dias atuais, ainda são usadas para espantar traças e baratas, bolinhas de naftalina nos guarda-roupas e gavetas. Com o passar do tempo, essas bolinhas diminuem de tamanho. Esse fenômeno é uma mudança de estado físico chamada de:
a) Condensação
b) Fusão
c) Evaporação
d) Sublimação
e) Solidificação
Comentários: Sublimação é quando o estado sólido passa direto para a fase gasosa, por aquecimento; ou oposto, tido por resfriamento. Exemplos: naftalina e gelo seco. Gabarito D.
a) Alternativa incorreta. Condensação é a mudança do estado gasoso para a fase líquida.
b) Alternativa incorreta. A fusão é a mudança do estado sólido para a fase líquida.
c) Alternativa incorreta. A evaporação é a mudança do estado líquido para a fase gasosa.
d) Gabarito.
e) Alternativa incorreta. É a mudança do estado líquido para a fase sólida.
Chegamos ao final do tópico sobre estados da matéria. Espero que você tenha gostado. Foi bem produtivo, né?! Também estou presente com dicas inéditas nas redes sociais do Estratégia Vestibulares. Até mais!
Por Matheus Durães
Veja também:
- Dicas para aprender Química
- Gases nobres: tire suas dúvidas!
- Dietilenoglicol: o caso envolvendo a produção da cerveja Belorizontina
- Equação de Clapeyron: o que é e como cai no vestibular?
- Equação de Nernst: o que é e como é cobrada em prova
- Destilação simples e fracionada: entenda a diferença
- Tabela periódica completa e atualizada
- Reações inorgânicas: definição, tipos e questões de vestibular
- Resolução Comentada Prova de Química Fuvest 2020




