Olá, pessoal… Tudo bem? Sou o prof. Prazeres, do Estratégia Vestibulares, e escrevo este artigo para lançar o Gabarito UEL 2020, da disciplina de Química. Nesta página, você vai conferir a resolução comentada completa. Vamos nessa??
Questões de química UEL 2020 comentadas
Questão 4
Uma criança, que participava de uma oficina de pintura em um museu, atingiu, acidentalmente, com tinta à base de óleo uma tela pintada com tinta à base de água. Como praticamente toda a tela foi manchada com pequenas gotículas de tinta, a restauração da obra exige cautela. Neste caso, pode-se utilizar microvolumes de solventes extratores capazes de dissolver a tinta à base de óleo, mas não a tinta à base de água. Para a obtenção desses solventes, empregam-se misturas ternárias constituídas de solvente extrator (responsável pela dissolução da tinta à base de óleo), solvente dispersor e água. O solvente dispersor deve ser miscível no solvente extrator e na água, mas a água não deve ser miscível no solvente extrator. Esse tipo de mistura, quando borrifada sobre a superfície da tela, forma nanogotas do solvente extrator e, por consequência, melhora a eficiência do processo de dissolução da tinta à base de óleo.
Com base nos conceitos de forças intermoleculares e miscibilidade e considerando que a quantidade de água na mistura ternária é incapaz de dissolver a tinta à base de água, assinale a alternativa que apresenta, corretamente, a mistura ternária, solvente extrator/solvente dispersor/água, que pode ser empregada para a remoção das manchas, sem danificar a tela.
a) acetona/metanol/água.
b) clorofórmio/acetona/água.
c) heptano/hexano/água.
d) hexano/heptano/água.
e) metanol/clorofórmio/água
Resolução Comentada
A mistura ternária é classificada por solvente extrator / solvente dispersor / água.
Solvente extrator: é o solvente que a água é imiscível, logo, deve ser insolúvel em água. Possibilidades corretas de solventes extratores apresentados: clorofórmio (pouco solúvel em água), heptano e hexano.
Solvente dispersor: apresenta características polares e apolares para ser solúvel em água e na fase orgânica. Possibilidades corretas apresentadas: acetona.
(Nota do Professor: Essa questão exigia a noção da baixa polaridade da molécula de clorofórmio e, por isso, baixa solubilidade em água.)
Gabarito: B
Questão 7
No Museu do Louvre, estão exibidos objetos metálicos usados por sociedades antigas. No passado, alguns desses metais eram encontrados praticamente em seu estado puro. Com o advento da metalurgia, puderam ser obtidos a partir de minerais submetidos a reações químicas.
Em relação aos processos de obtenção de metais a partir de minerais, e com base nos conhecimentos sobre reações de oxidorredução, considere as afirmativas a seguir.
I. Alo (s) pode ser obtido a partir de bauxita (Al2O3·H2O) por meio de um método eletrolítico, o qual é baseado num processo não espontâneo onde Al3+ é reduzido a Alo (s).
II. Cuo (s) pode ser obtido a partir da queima de sulfeto de cobre, conforme reação Cu2S(s) + O2(g) →2Cu(s) + SO2(g), onde o número de oxidação do cobre muda de (1+) para (0).
III. Feo (s) pode ser obtido a partir de reações de redução de óxidos de ferro conforme transformações químicas: Fe2O3(s) →FeO2(s) →Feo (s).
IV. Mno (s) pode ser obtido a partir da reação MnO2(s)+ C(s) →Mn(s) + CO2(g) em que o átomo de oxigênio em MnO2(s) é o redutor e o carbono (C) é o oxidante.
Assinale a alternativa correta.
a) Somente as afirmativas I e II são corretas.
b) Somente as afirmativas I e IV são corretas.
c) Somente as afirmativas III e IV são corretas.
d) Somente as afirmativas I, II e III são corretas.
e) Somente as afirmativas II, III e IV são corretas.
Resolução Comentada
I. Certo. O alumínio, na bauxita, encontra-se na forma catiônica Al3+, logo, para transformar-se em alumínio metálico é necessário ocorrer a sua redução. A reação de redução do alumínio é realizada pela eletrólise ígnea.
II. Certo. A partir do balanceamento da reação de oxirredução, percebe-se que essa reação é possível porque os elétrons cedidos são iguais aos elétrons recebidos:
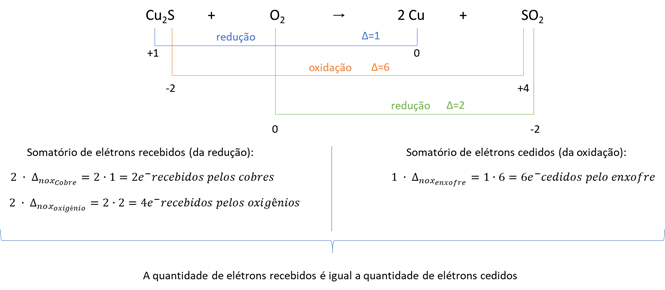
III. Errado. Segundo o procedimento descrito no item a transformação ocorre de Fe2O3 para FeO2 para Fe. O nox do elemento ferro das fórmulas é: Fe2O3 (nox do ferro igual a +3), FeO2 (nox do ferro igual a +4) e Fe (nox do ferro igual a zero). Assim, as etapas das reações seriam classificadas em oxidação e redução, enquanto o item afirma que seriam reações de redução.
IV. Errado. O átomo de oxigênio não participa da transferência dos elétrons porque o nox do oxigênio não muda é igual a -2 tanto na substância MnO2 quanto na substância CO2. O agente redutor (quem provoca a redução) da reação é o C(s), enquanto o agente oxidante é o MnO2.
Gabarito: A
Questão 15
Crime no Museu! Uma estatueta em bronze, constituída por 90% de cobre e 10% de alumínio, foi roubada. Depois de alguns dias, uma estatueta, com características semelhantes foi encontrada, aos pedaços, em uma lixeira. Foi realizada uma análise para confirmar sua autenticidade, pois a composição desta estatueta poderia ser de latão, constituída de 90% de cobre e 10% de zinco. Primeiramente, massas de 0,50 g retiradas dos pedaços encontrados foram dissolvidas em HNO3 5,0 mol·L−1, formando íons em solução. Em seguida, alíquotas dessa solução ácida foram alcalinizadas com solução de NaOH para a formação de precipitados azul e branco visualmente distinguíveis e, na sequência, foram adicionadas soluções aquosas de NH4Cl. As equações químicas das reações que podem ocorrer com a adição dos reagentes são apresentadas a seguir:

Com base no texto e nas equações químicas, assinale a alternativa que apresenta, corretamente, o resultado experimental que comprova que a estatueta encontrada na lixeira é de bronze.
a) Presença de precipitado branco após a adição de solução de NaOH.
b) Ausência de dissolução do precipitado azul após a adição de solução de NH4Cl.
c) Presença de precipitado azul após a adição de solução NaOH.
d) Dissolução do precipitado branco após a adição de solução de NH4Cl.
e) Ausência de dissolução do precipitado branco após a adição de solução de NH4Cl.
Resolução Comentada
Interpretando a questão: ao final da questão foi confirmado que o material é formado de bronze (90% de cobre e 10% de alumínio) em “o resultado experimental que comprova que a estatueta encontrada na lixeira é de bronze”. Assim, sabe-se que o material não apresenta zinco. Tanto o zinco, quanto o alumínio formam bases que são precipitados brancos, porém, somente o hidróxido de zinco se dissolve em cloreto de amônio. O material, por ser feito de bronze, apresenta alumínio e não apresenta zinco em sua composição, logo, o hidróxido de alumínio formado não se dissolve em solução de cloreto de amônio.
Julgando os itens, tem-se:
- LETRA A – Errado. Porque tanto o zinco, quanto o alumínio formam precipitados brancos.
- LETRA B – Errado. O precipitado azul evidencia a presença de cobre, que é encontrado nos dois materiais.
- LETRA C – Errado. A presença de precipitado azul confirma a presença de cobre, que é componente de ambos materiais.
- LETRA D – Errado. A dissolução do precipitado branco confirma a presença de zinco, ou seja, confirmaria a composição de latão. Porém, segundo o texto da questão, o material é formado de bronze.
- LETRA E – Certo. O precipitado branco de hidróxido de alumínio deve ser encontrado ao final da reação.
Gabarito: E
Questão 22
Nos museus, algumas peças são hermeticamente conservadas em redomas de vidro contendo gases nobres, tal como o argônio que, por ser inerte, previne processos de oxidação. Em um museu, os diretores constataram que, ao longo do tempo, as partes metálicas de um relógio fabricado por volta de 1950 estavam sendo oxidadas, indicando que, além do gás argônio, havia gás oxigênio dentro da redoma. Um experimento foi realizado com o intuito de determinar a presença de gás oxigênio dentro da redoma. Para tanto, 10,0 L da mistura gasosa contida na redoma foram coletados com uma seringa hermética, sendo que 5,0 L da mistura foram transferidos para um frasco com capacidade volumétrica de 30,0 L contendo 1,0 g de gás hidrogênio. Em seguida, fez-se passar uma faísca elétrica pela mistura resultando na reação entre gás hidrogênio e oxigênio, sem excesso de reagentes com formação de água na fase gasosa.
Sabendo que não houve variação da temperatura (298 K) e do volume do frasco, e que a pressão final no frasco foi de 2,0 atm, assinale a alternativa que apresenta, correta e respectivamente, a quantidade, em mols, de argônio e de oxigênio contidos na alíquota de 5,0 L da seringa.
Dados: Massa atômica do H = 1 u
R = 0,082 atm·L·K−1·mol−1
a) 1,95 e 0,25
b) 2,45 e 0,50
c) 2,95 e 0,82
d) 4,35 e 0,43
e) 4,85 e 1,00
Resolução Comentada
Inicialmente, calcula-se o número de mols de O2 consumido por 1 g de H2, tendo em vista que a reação não apresentou excesso dos reagentes.
2 H2 + 1 O2 → 2 H2O


x = 0,25 mol de O2
(Assim, sabe-se que a resposta é o item a. Porém, continuarei)
Sabe-se que a pressão de 2 atm no frasco de 30 litros é proveniente da mistura de água e argônio. Calcula-se o número de mols de água formada e determina-se a pressão de água no sistema de 30 L e 298 K:

y = 0,5 mol de H2O
A pressão de 0,5 mol de H2O a 298 K em 30 L é:
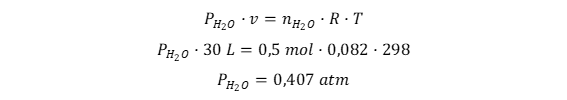
A pressão total do sistema é de 2 atm, logo:
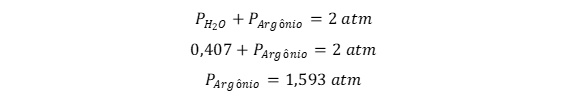
Calcula-se o número de mols de argônio, a partir da pressão parcial de argônio igual a 1,593 atm, temperatura de 298 K e volume de 30 litros:
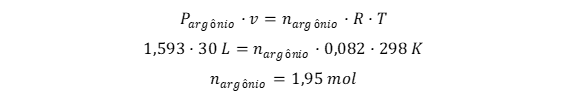
Gabarito: A
Questão 36
A presença de nanomateriais é bem perceptível no cálice de Lycurgus que muda sua coloração, passando de verde para vermelha, quando exposto à luz branca. Isso ocorre devido à presença de nanopartículas de ouro e prata na composição do vidro do cálice.
Admitindo o comportamento ideal de uma solução aquosa não coloidal contida no cálice, formada por 200 mL de água pura (solvente) e por nanopartículas metálicas de ouro e prata (solutos não eletrólitos) que se desprenderam da parede interna sob pressão de 1,0 atm, e com base nos conceitos sobre propriedades coligativas, assinale a alternativa correta.

Vidro, Altura: 15,8 cm (6.2 pol.)
Museu Britânico
a) A temperatura de solidificação da solução aquosa é maior que a do solvente puro.
b) A temperatura de ebulição da solução aquosa é maior que a do solvente puro.
c) A densidade da solução é menor que a do solvente puro.
d) A pressão de vapor do solvente na solução é maior que da água pura, sob mesma temperatura.
e) A elevação da temperatura de solidificação da solução depende da natureza química do soluto não volátil.
Resolução Comentada
Julgando os itens, tem-se:
- LETRA A – Errado. A temperatura de solidificação da solução aquosa é menor que a do solvente puro, porque a dissolução de um soluto não volátil diminui a temperatura de congelamento.
- LETRA B – Certo. Ao adicionar um soluto não volátil, a temperatura de ebulição aumenta e esse fenômeno é chamado ebulioscopia. Isso ocorre devido ao aumento na intensidade das interações entre as partículas no sistema aquoso.
- LETRA C – Errado. Considerando que o volume de uma solução aquosa é, praticamente, igual ao volume do solvente, a adição de um soluto aumenta a densidade de um solução. Aumenta-se a massa do sistema, enquanto o volume permanece constante.
- LETRA D – Errado. Ao adicionar um soluto não volátil a um solvente, aumenta-se as forças atrativas dentro da solução que dificultam a vaporização do solvente. Assim, ao adicionar um soluto não volátil, diminui-se a pressão de vapor da solução.
- LETRA E – Errado. A natureza do soluto (iônico ou molecular) não interfere na propriedade coligativa. O fator determinante dessa propriedade é a quantidade de partículas dissolvidas.
Gabarito: B
Questão 60
Obras de arte expostas em museus podem conter metais tóxicos em sua composição, como chumbo, cádmio ou mercúrio e/ou seus óxidos. Um incêndio em um museu no qual obras de arte contendo mercúrio são incineradas pode gerar dimetilmercúrio ((CH3)2Hg), uma neurotoxina altamente letal mesmo em baixas concentrações (0,030 mg/cm3). Se inalado, os sintomas costumam aparecer semanas após a exposição inicial, o que torna ineficaz qualquer tipo de tratamento. As equações químicas 1 e 2 são exemplos de reações químicas de formação do composto dimetilmercúrio.
Equação 1:
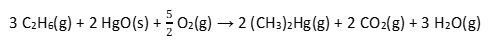
Equação 2:
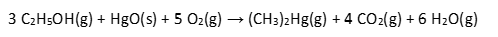
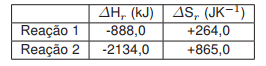
Com base no texto, nos conhecimentos sobre termodinâmica e cinética química, e supondo a queima total de HgO a 1 atm e a 300 K, assinale a alternativa correta.
a) A reação 1 possui maior espontaneidade que a reação 2 por possuir maior velocidade de reação.
b) A reação 2, com valor de ΔGr igual a -967,2 kJ, possui menor espontaneidade que a reação 1.
c) A reação 1 possui maior valor de variação de entalpia (ΔHr) que a reação 2 e, por isso, libera mais calor.
d) A reação 2, com valor de ΔGr igual a -2393,5 kJ, possui maior espontaneidade que a reação 1.
e) A reação 2 é endotérmica e possui menor valor de variação de entropia(ΔSr) que a reação 1.
Resolução Comentada
A espontaneidade de uma reação química pode ser prevista de acordo com a equação de Gibbs:
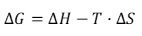
Em que, ΔG negativos caracterizam reações espontâneas, ΔH é a energia absorvida ou liberada por uma reação química, T é a temperatura e ΔS é a variação de entropia de uma reação química.
Portanto, em uma reação química, quanto maior a quantidade de energia liberada e maior a desorganização de uma transformação, maior será a espontaneidade de uma reação química.
Estimando os valores de ΔG para as equações 1 e 2, tem-se:
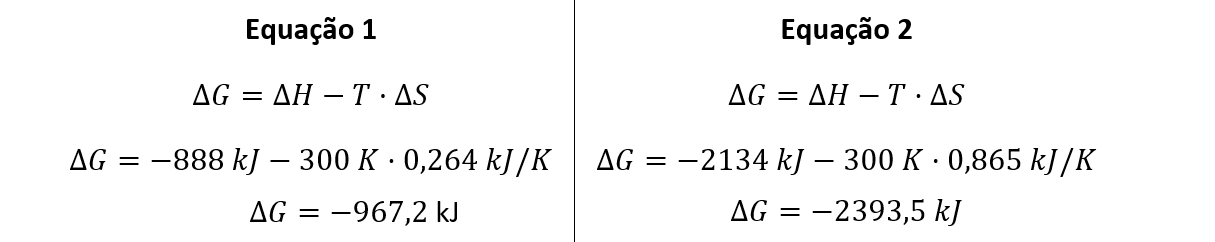
A uma mesma temperatura, a reação 2 apresenta valor menor do que a reação 1, ou seja, a reação 2 é mais espontânea.
Gabarito: D
É isso, pessoal! Espero que tenham curtido a resolução da prova de Química do vestibular UEL 2020. Sigam-me nas redes sociais. Têm muitas dicas lá. Mande uma mensagem, caso tenha tido alguma dúvida. Abraços!
Instagram: @professorprazeres
Confira também o texto guia do vestibular UEL para saber tudo sobre o processo seletivo e a universidade, além de cursos e simulados!




