Você já parou para pensar o porquê o gelo congela mais rápido do que uma sobremesa colocada no congelador ao mesmo tempo? A resposta é que as diferenças das soluções químicas possibilita uma temperatura de congelamento mais para a solução mais concentrada. Essa aplicação real da física e química é realizada por meio do conhecimento das propriedades coligativas.
Para compreender melhor esse tema, neste artigo, você aprenderá mais sobre essas propriedades, que variam conforme a concentração de soluto, mas não são dependentes do tipo de partículas do soluto. Entenda a tonoscopia, a ebulioscopia, a crioscopia, a osmose e observe o uso desses conceitos no cotidiano.
Navegue pelo conteúdo
O que são propriedades coligativas?
Propriedades coligativas são características observadas em soluções quando é adicionado um soluto não volátil, de forma que a quantidade de soluto é determinante para o aspecto observado, independentemente de qual é o tipo de soluto inserido, seja ele iônico ou molecular.
Primeiro, vamos recordar alguns conceitos importantes. Uma solução é uma mistura de duas ou mais substâncias de fórmulas químicas diferentes, mas que formam um conteúdo homogêneo. Por exemplo, quando misturamos um pouco de sal em um balde d’água, haverão tipos de moléculas diferentes, mas existe homogeneidade à olho nu.
A concentração de uma solução diz respeito à quantidade de partículas de soluto que estão distribuídas dentro do soluto. Em geral, ela pode ser expressa em mol por litro ou gramas por litro, a depender do enunciado apresentado.
Como modelo, imagine que colocamos 10 gramas de açúcar em 2 litros de água. A massa ficará dispersa na solução, de forma que a cada litro de água existem 5 gramas de açúcar. Esse cálculo é feito por meio da fórmula: C = m/V, em que C é a concentração, m é a massa de soluto e V é o volume de solvente.
As quatro propriedades coligativas
A dispersão do soluto no solvente altera algumas características comportamentais físico-químicas da solução. Nos tópicos abaixo, estudaremos as propriedades coligativas e a relação delas com a concentração dos preparos químicos.
Tonoscopia ou tonometria
A tonoscopia ocorre quando ocorre a redução da pressão de vapor de uma solução. A pressão de vapor (Pv) é o conceito físico para o momento em que está ocorrendo evaporação, com coexistência de moléculas líquidas e gasosas.
Nesse sentido, o abaixamento da Pv resulta em uma menor conversão de moléculas líquidas para o estado de vapor. Ou seja, quando ocorre o efeito tonscópico, a capacidade de evaporação da solução é menor, à mesma temperatura.
Se colocarmos uma caneca de água para ferver e, ao mesmo tempo, uma caneca de mesmo volume com água e açúcar, vamos observar que a água pura entra em ebulição mais rápido que a outra.
Ebulioscopia ou ebuliometria
Nessa propriedade coligativa nota-se que a adição de solutos não voláteis em uma solução determina uma temperatura de ebulição aumentada.
O comportamento é proporcional à concentração de soluto adicionado. Ou seja, o aumento da massa de soluto por volume de solvente determina um acréscimo na temperatura de ebulição. Isso significa que uma panela com água, óleo e sal ferve com em temperatura mais alta que uma panela de água pura.
Crioscopia ou criometria
A crioscopia é uma propriedade coligativa interessante, muito utilizada em países com invernos rigorosos, como veremos adiante. O funcionamento desse conceito é dado pela diminuição do ponto de congelamento da solução.
Por exemplo, se colocarmos uma forma de água pura no congelador e, ao mesmo tempo, adicionarmos uma forma de água com açúcar, a água com açúcar demora mais a congelar. Isso explica, em partes, porque as sobremesas demoram tanto para gelar, enquanto as garrafas de água resfriam tão rapidamente.
Semelhante ao que foi observado na ebulioscopia, o efeito crioscópico é diretamente proporcional à concentração de soluto: quanto maior a concentração, maior a redução do ponto de congelamento.
Osmose e pressão osmótica
A osmose é uma propriedade coligativa muito conhecida, porque acontece em meio intra e extracelular, principalmente nas plantas, mas também no corpo humano.
O conceito de osmose diz respeito à passagem de solvente por meio de uma membrana semipermeável, conforme as concentrações de soluto presentes nos lados internos e externos da película em questão.
O fluxo de passagem do solvente é sempre da região menos concentrada para a mais concentrada. Para lembrar disso, pense que o efeito osmótico busca o equilíbrio entre as soluções. Assim, quando há muito mais soluto de um lado do que do outro, o solvente se distribui para deixar a quantidade de moléculas dissolvidas igual em ambas as partes.
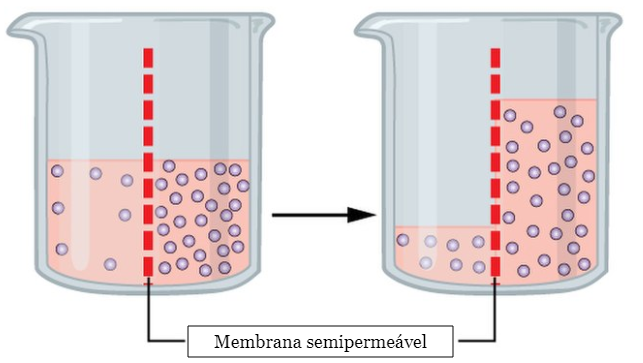
Na imagem acima, note que a variação é na concentração da solução. Isso significa que, ao final da osmose, um lado pode possuir maior volume de solvente, desde que ambos tenham aproximadamente a mesma massa de soluto por volume da solução.
Para que o processo ocorra, é necessário que a pressão osmótica (π) seja vencida. Essa pressão é o ente físico que tenta impedir a acontecimento da osmose e está relacionada com a temperatura (T) da substância em Kelvin (K), com a molaridade da solução (M = concentração em mol por litro) e com a constante universal dos gases perfeitos (R =0,082 atm.L.mol-1.K-1) conforme a fórmula: π = M x R x T.
Aplicação das propriedades coligativas
Algumas propriedades coligativas são particularmente interessantes, vamos entender o uso delas no cotidiano com os exemplos abaixo.
Em países de climas frios, os carros possuem radiadores com uma solução de água e um soluto não volátil. Essa adição é realizada para diminuir o ponto de congelamento da H2O, pelo efeito crioscópico. Com isso, impede-se que a água congele quando a temperatura atmosférica estiver muito baixa.
Em países tropicais, por outro lado, essa aplicação é feita para diminuir a evaporação da água quando o dia está muito quente. Por meio do efeito ebulioscópico, sabemos que uma solução concentrada terá uma temperatura de ebulição mais alta do que o solvente puro.
A osmose aparece na conservação de alimentos. Para entender esse processo, vamos relembrar que a água, quando em contato com os alimentos, favorece a metabolização e putrefação deles.
Então, ao adicionarmos sal na superfície das carnes, direcionamos toda a água solvente para o ambiente externo do alimento (a superfície está mais concentrada de sais). Dessa forma, a ação da água sobre a decomposição é mínima e, como consequência, o apodrecimento é retardado.
+ Veja também: Química geral: o que é e principais assuntos
Planeje seus estudos com a Coruja!
Nos pacotes do Estratégia Vestibulares, você pode acessar trilhas estratégias: cronogramas completos, criados por aprovados da Coruja, que te guiam sobre o que, como e quando estudar. Tudo isso associado a aulas didáticas, que te dão a base de conteúdo necessária para realizar sua prova. Clique no banner e saiba mais.
Veja Também
- Ligações químicas: tipos, características e exercícios
- Ligações iônicas: o que são, como fazer?
- Geometria molecular: o que é, quais são e exemplos
- Forças intermoleculares: iônica, covalente, metálica, dipolos e hidrogênio
- Polaridade molecular: o que é, como acontece e exercícios
- Distribuição eletrônica: níveis de energia, diagrama e como usar
- Oxirredução: troca de elétrons e balanceamento
- Massa molar: o que é, número de mol, como calcular e questões
- Concentração molar: o que é, como calcular e aplicações




