Olá, pessoal… Tudo bem? Prof. Prazeres na área, professor de Química do Estratégia Vestibulares, escrevendo este artigo para resolver a prova de química FUVEST 2020. Nesta página, você vai conferir os meus comentários e a resolução de todas as questões de química. Vamos nessa??
Navegue pelo conteúdo
Prova FUVEST 2020
Questão 01

Em Xangai, uma loja especializada em café oferece uma opção diferente para adoçar a bebida. A chamada sweet little rain consiste em uma xícara de café sobre a qual é pendurado um algodão‐doce, material rico em sacarose, o que passa a impressão de existir uma nuvem pairando sobre o café, conforme ilustrado na imagem.
O café quente é então adicionado na xícara e, passado um tempo, gotículas começam a pingar sobre a bebida, simulando uma chuva doce e reconfortante. A adição de café quente inicia o processo descrito, pois
(A) a temperatura do café é suficiente para liquefazer a sacarose do algodão‐doce, fazendo com que este goteje na forma de sacarose líquida.
(B) o vapor de água que sai do café quente irá condensar na superfície do algodão‐doce, gotejando na forma de água pura.
(C) a sacarose que evapora do café quente condensa na superfície do algodão‐doce e goteja na forma de uma solução de sacarose em água.
(D) o vapor de água encontra o algodão‐doce e solubiliza a sacarose, que goteja na forma de uma solução de sacarose em água.
(E) o vapor de água encontra o algodão‐doce e vaporiza a sacarose, que goteja na forma de uma solução de sacarose em água.
Note e adote:
Temperatura de fusão da sacarose à pressão ambiente = 186 °C;
Solubilidade da sacarose a 20 °C = 1,97 kg/L de água.
Resolução Comentada da questão 1 da prova química Fuvest 2020
Julgando os itens, tem-se:
- a) Errado. A liquefação é a passagem do estado gasoso para o estado líquido. A sacarose é dissolvida pelo vapor de água.
- b) Errado. A água não é gotejada como água pura, mas como solução aquosa de sacarose.
- c) Errado. A sacarose apresenta elevada temperatura de fusão e ebulição, portanto, não ocorre alteração de estado físico da sacarose.
- d) Certo. O vapor de água liberado pelo café, condensa no algodão-doce e, assim, dissolve a sacarose presente. A solução que goteja no café aumenta o seu sabor doce.
- e) Errado. A sacarose apresenta elevada temperatura de fusão e ebulição, portanto, não ocorre alteração de estado físico da sacarose.
Gabarito: D
Questão 02
Equipamentos domésticos chamados de vaporizadores para roupa utilizam o vapor de água gerado por um sistema de resistências elétricas a partir de água líquida. Um equipamento com potência nominal de 1.600 W foi utilizado para passar roupas por 20 minutos, consumindo 540 mL de água. Em relação ao gasto total de energia do equipamento, o gasto de energia utilizado apenas para vaporizar a água, após ela já ter atingido a temperatura de ebulição, equivale a, aproximadamente,
(A) 0,04%.
(B) 0,062%.
(C) 4,6%.
(D) 40%.
(E) 62%.
Note e adote:
Entalpia de vaporização da água a 100 °C = 40 kJ/mol;
Massa molar da água = 18 g/mol;
Densidade da água = 1 g/mL.
Resolução Comentada
(energia necessária para vaporizar 540 mL de água)
Gabarito: E
Questão 03
Pesquisadores(…) conseguiram controlar reações químicas de um modo inovador. Usaram feixes de laser para promover um esbarrão entre dois átomos e uni‐los, criando uma molécula. Utilizando pinças ópticas (feixes de laser altamente focados capazes de aprisionar objetos microscópicos), os pesquisadores empurraram um átomo do elemento químico césio (Cs) contra um átomo de sódio (Na) até que colidissem. Um terceiro laser foi lançado sobre ambos, fornecendo energia extra para criar a molécula NaCs. Na natureza, as moléculas formam‐se a partir da interação de átomos por acaso. Por suas características químicas, césio e sódio jamais originariam uma molécula espontaneamente. (…)
Molécula criada em laboratório. Disponível em http://revistapesquisa.fapesp.br/. Adaptado. Com base nas informações do texto e em seus conhecimentos, é correto afirmar que
(A) o Cs é um elemento químico radioativo e, devido a essa característica química, a molécula de NaCs não se formaria sem esse modo inovador (L.2), que estabiliza o decaimento.
(B) o raio atômico do Na é maior que o do Cs, portanto, a sua energia de ionização também é maior. O esbarrão (L.3) entre os átomosretira um elétron do Na, permitindo a ligação.
(C) o terceiro laser (L.8) usado no experimento serviu para retirar um nêutron do Cs, tornando‐o um cátion e possibilitando a reação com o Na.
(D) na natureza, com esses elementos se esbarrando por acaso (L.10‐11), a tendência seria formar CsNa, e não NaCs, justificando o caráter inovador do experimento.
(E) o Cs e o Na não formariamuma molécula espontaneamente (L.11‐12), uma vez que ambos têm grande tendência a formarem cátions e ligações iônicas.
Resolução Comentada da questão 3 da prova química Fuvest 2020
Julgando os itens, tem-se:
- a) Errado. A propriedade nuclear de um elemento, independe, da combinação elétrica entre os elementos.
- b) Errado. O sódio apresenta raio atômico menor do que o césio.
- c) Errado. Para formar um cátion, retira-se elétron de um elemento.
- d) Errado. Na natureza, os elementos sódio e césio poderiam se combinar por ligação metálica e não faria diferença entre CsNa e NaCs.
- e) Certo. Segundo o texto, a combinação césio e sódio formou uma molécula, ou seja, uma ligação covalente com compartilhamento de elétrons. Essa ligação entre esses elementos, naturalmente, é difícil devido à elevada tendência à perder elétrons.
Gabarito: E
Questão 04
Ao se preparar molho de tomate (considere apenas a fervura de tomate batido com água e azeite), é possível observar que a fração aquosa (fase inferior) fica vermelha logo no início e a fração oleosa (fase superior), inicialmente com a cor característica do azeite, começa a ficar avermelhada conforme o preparo do molho. Por outro lado, ao se preparar uma sopa de beterraba (considere apenas a fervura de beterraba batida com água e azeite), a fração aquosa (fase inferior) fica com a cor rosada e a fração oleosa (fase superior) permanece com sua coloração típica durante todo o processo, não tendo sua cor alterada.
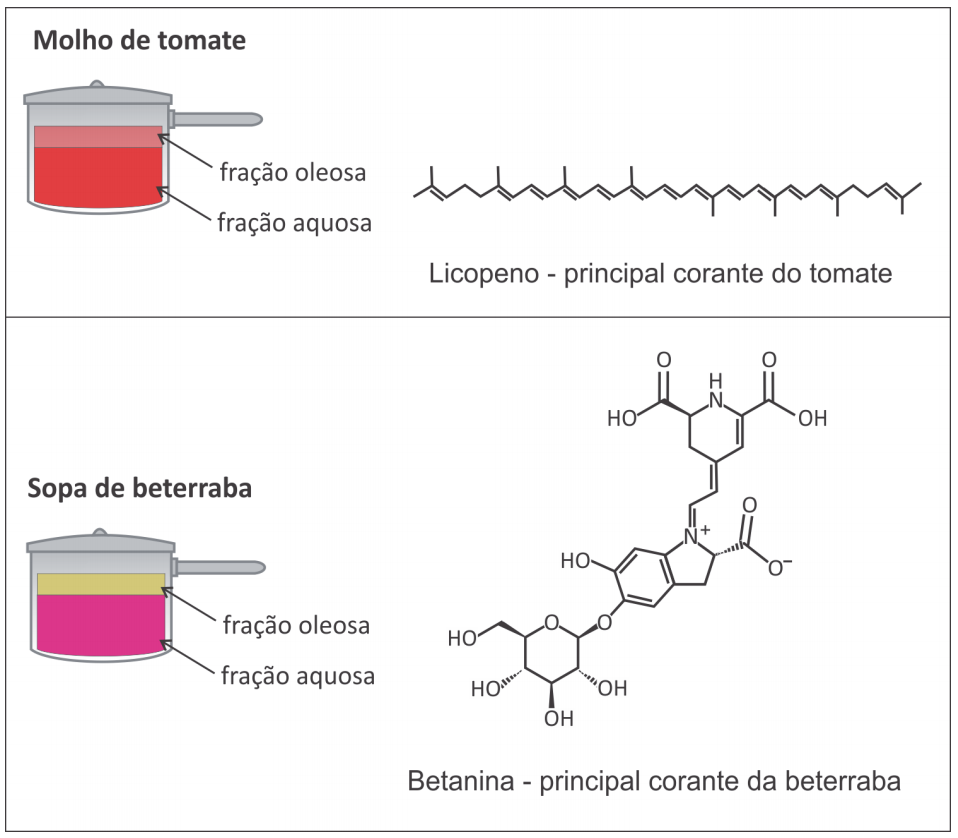
Considerando as informações apresentadas no texto e no quadro, a principal razão para a diferença de coloração descrita é que a fração oleosa
(A) fica mais quente do que a aquosa, degradando a betanina; o mesmo não é observado com o licopeno, devido à sua cadeia carbônica longa.
(B) está mais exposta ao ar, que oxida a betanina; o mesmo não é observado com o licopeno, devido à grande quantidade de duplas ligações.
(C) é apolar e a betanina, polar, havendo pouca interação; o mesmo não é observado com o licopeno, que é apolar e irá interagir com o azeite.
(D) é apolar e a aquosa, polar, mantendo‐se separadas; o licopeno age como um surfactante misturando as fases, colorindo a oleosa, enquanto a betanina não.
(E) tem alta viscosidade, facilitando a difusão do licopeno, composto de menor massa molar; o mesmo não é observado para a betanina, com maior massa.
Note e adote:
Massas molares (g/mol):
Licopeno = 537; betanina = 551.
Resolução Comentada
Julgando os itens, tem-se:
- a) Errado. Segundo o texto, não aconteceu aquecimento durante o procedimento, mas sim diferença nas solubilidades dos compostos.
- b) Errado. O texto não apresenta informação para afirmar de alguma reação de oxidação entre as substâncias, mas diferenças entre as solubilidades dos corantes.
- c) Certo. O licopeno é um hidrocarboneto. Os hidrocarbonetos são apolares e insolúveis em água, logo, são solúveis em fase oleosa. A betanina é bastante polar devido ao número de ligações de hidrogênio e ao acúmulo de cargas iônicas, portanto, é solúvel em fase aquosa.
- d) Errado. Para que o licopeno seja surfactante é necessário ter grupo polar e apolar, porém o licopeno é um hidrocarboneto, somente apolar.
- e) Errado. A difusão das moléculas pelas fases é justificada pelas diferenças de polaridade e não pelas massas.
Gabarito: C
Questão 05
Numa determinada condição experimental e com o catalisador adequado, ocorre uma reação, conforme representada no gráfico, que relaciona porcentagem do composto pelo tempo de reação.
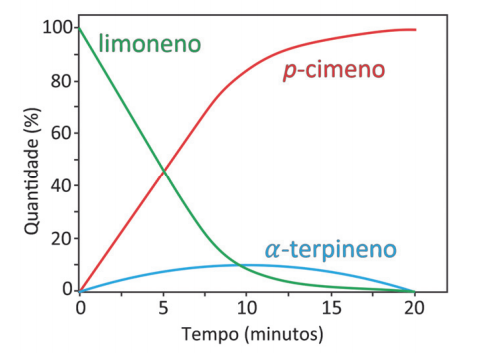
Uma representação adequada para esse processo é:
(A)
(B)
(C)
(D)
(E)
Resolução Comentadada questão 5 da prova química Fuvest 2020
O limoneno é consumido durante a reação, portanto, é o reagente.
O p-cimeno é formado durante a reação, portanto, é o produto.
O alfa-terpineno não é catalisador, porque não apresenta quantidade inicial no tempo zero, é formado e consumido durante a reação. Assim, essa substância é o intermediário da reação.
Gabarito: E
Questão 06
Os chamados “remédios homeopáticos” são produzidos seguindo a farmacotécnica homeopática, que se baseia em diluições sequenciais de determinados compostos naturais. A dosagem utilizada desses produtos é da ordem de poucos mL. Uma das técnicas de diluição homeopática é chamada de diluição centesimal (CH), ou seja, uma parte da solução é diluída em 99 partes de solvente e a solução resultante é homogeneizada (ver esquema). Alguns desses produtos homeopáticos são produzidos com até 200 diluições centesimais sequenciais(200CH).
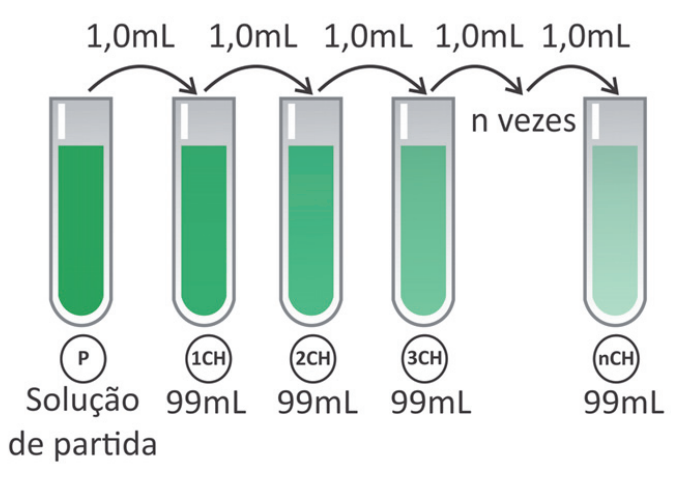
Considerando uma solução de partida de 100 mL com concentração 1 mol/L de princípio ativo, a partir de qual diluição centesimal a solução passa a não ter, em média, nem mesmo uma molécula do princípio ativo?
(A) 12ª diluição (12CH).
(B) 24ª diluição (24CH).
(C) 51ª diluição (51CH).
(D) 99ª diluição (99CH).
(E) 200ª diluição (200CH).
Note e adote:
Número de Avogadro = 6 × 1023.
Resolução Comentada da questão 6 da prova química Fuvest 2020
A quantidade de soluto não é alterada, apenas aumenta-se a proporção de solvente na mistura na ordem de cem vezes mais. Logo, a concentração do soluto é calculada por:
Concentração =
Sendo n o número de diluições realizadas.
Portanto,
Quando n for igual a 12, tem-se que a quantidade diluída é maior que o número de Avogadro:
Assim, para diluições a partir de 12 (12CH), é possível que não contenha mais partículas dentro do recipiente.
Gabarito: A
Questão 07
O gás hélio disponível comercialmente pode ser gerado pelo decaimento radioativo, sobretudo do urânio, conforme esquematizado pela série de decaimento. Desde a formação da Terra, há 4,5 bilhões de anos, apenas metade do 238U decaiu para a formação de He.
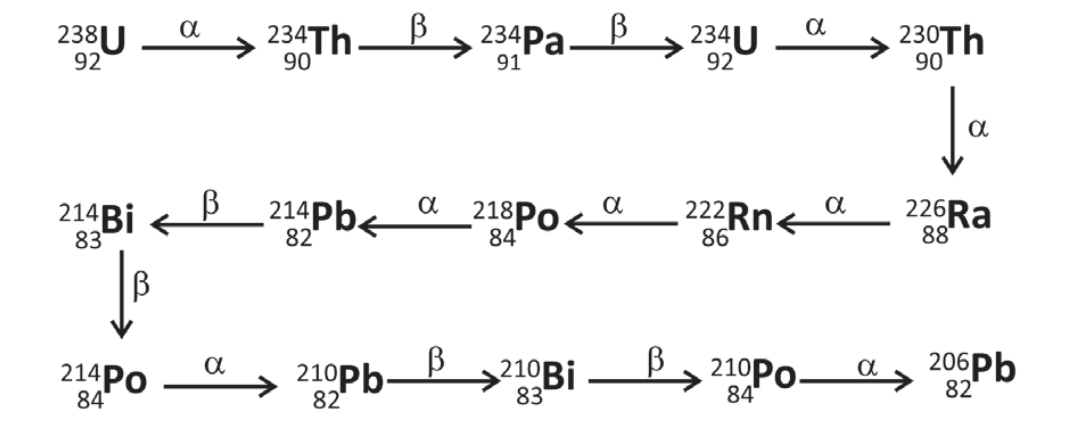
Com base nessas informações e em seus conhecimentos, é correto afirmar:
(A) O decaimento de um átomo de 238U produz, ao final da série de decaimento, apenas um átomo de He.
(B) O decaimento do 238U para 234U gera a mesma quantidade de He que o decaimento do 234U para 230Th.
(C) Daqui a 4,5 bilhões de anos, a quantidade de He no planeta Terra será o dobro da atual.
(D) O decaimento do 238U para 234U gera a mesma quantidade de He que o decaimento do 214Pb para 214Po.
(E) A produção de He ocorre pela sequência de decaimento a partir do 206Pb.
Resolução Comentada
Julgando os itens, tem-se:
- a) Errado. Ao longo do decaimento do urânio-238 são emitidas 8 partículas alfa, que são transformadas em 8 átomos hélio.
- b) Certo. Ambos os processos emitem uma partícula alfa, que é transformada em um átomo de hélio.
- c) Errado. Após 4,5 milhões de anos apresentaria 75% a mais da quantidade inicial, ou seja, 50% mais 25%, se toda a quantidade de hélio se acumulasse e fosse proveniente, apenas, da série do urânio-238.
- d) Errado. Do U-238 a U-234 é emitido um alfa, enquanto não é emitido alfa na conversão de Pb-214 a Po-214.
- e) Errado. O chumbo-206 não sofre reação de decaimento, pois é o produto final da série.
Gabarito: B
Questão 08
Os movimentos das moléculas antes e depois de uma reação química obedecem aos princípios físicos de colisões. Para tanto, cada átomo é representado como um corpo pontual com uma certa massa, ocupando uma posição no espaço e com uma determinada velocidade (representada na forma vetorial). Costumeiramente, os corpos pontuais são representados como esferas com diâmetros proporcionais à massa atômica. As colisões ocorrem conservando a quantidade de movimento.
Considerando um referencial no qual as moléculas neutras encontram‐se paradas antes e após a colisão, a alternativa que melhor representa o arranjo de íons e moléculas instantes antes e instantes depois de uma colisão que leva à reação
é
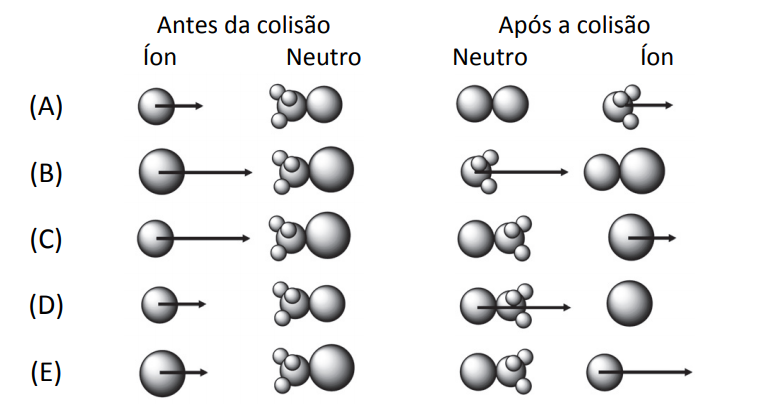
Note e adote:
Massas atômicas: H = 1 u.m.a., C = 12 u.m.a., F = 19 u.m.a. e Cl = 35 u.m.a. Considere que apenas o isótopo de cloro Cl = 35 u.m.a. participa da reação.
Resolução Comentada
A ilustração correta deve cumprir os seguintes quesitos:
· As moléculas (ilustração: aglomerados de bolinhas) devem estar paradas.
· A velocidade da partícula F é maior do que a partícula Cl, porque a massa de F é menor do que a massa de Cl.
· O tamanho de F é menor do que o tamanho de Cl.
A única ilustração que apresenta todas as características é a ilustração C.
Gabarito: C
Questão 09
Quando o nosso corpo é lesionado por uma pancada, logo se cria um hematoma que, ao longo do tempo, muda de cor. Inicialmente, o hematoma torna‐se avermelhado pelo acúmulo de hemoglobina. Em seguida, surge uma coloração azulada, decorrente da perda do O2 ligado ao Fe do grupo heme. Essa coloração torna‐se, então, esverdeada (biliverdina) e, após isso, surge um tom amarelado na pele (bilirrubina). Essa sequência de cores ocorre pela transformação do grupo heme da hemoglobina, como representado a seguir:
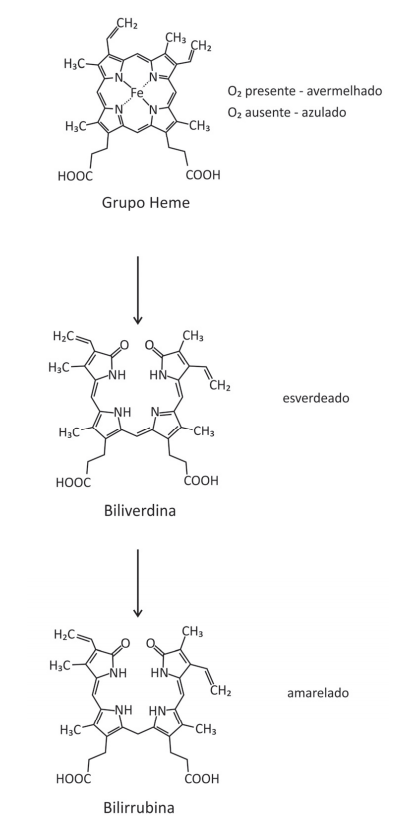
Com base nas informações e nas representações, é correto afirmar:
(A) A conversão da biliverdina em bilirrubina ocorre por meio de uma redução.
(B) A biliverdina, assim como a hemoglobina, é capaz de transportar O2 para as células do corpo, pois há oxigênio ligado na molécula.
(C) As três estruturas apresentadas contêm o grupo funcional amida.
(D) A degradação do grupo heme para a formação da biliverdina produz duas cetonas.
(E) O grupo heme, a biliverdina e a bilirrubina são isômeros.
Resolução Comentada da questão 9 da prova química Fuvest 2020
Julgando os itens, tem-se:
- a) Certo. A reação de transformação da biliverdina em bilirrubina é uma reação de adição por hidrogenação, que é uma reação de redução. O elemento carbono diminuiu o nox de -1 para -2.
- b) Errado. Os oxigênios ligados às estruturas orgânicas estão combinados por interações intermoleculares.
- c) Errado. O grupo heme não apresenta a função amida.
- d) Errado. Não existem cetonas nas estruturas orgânicas. As carbonilas estão presentes nas funções ácido carboxílico e amida.
- e) Errado. As estruturas orgânicas não apresentam a mesma fórmula molecular, portanto não são isômeros.
Gabarito: A
Questão 10
A reação de cetonas com hidrazinas, representada pela equação química
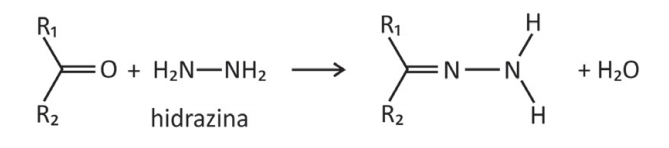
pode ser explorada para a quantificação de compostos cetônicos gerados, por exemplo, pela respiração humana. Para tanto, uma hidrazina específica, a 2,4‐dinitrofenilhidrazina, é utilizada como reagente, gerando um produto que possui cor intensa.
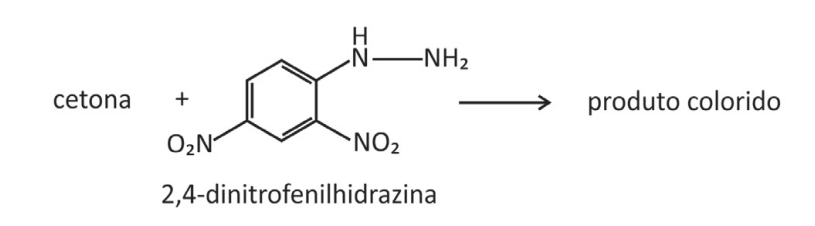
Considere que a 2,4‐dinitrofenilhidrazina seja utilizada para quantificar o seguinte composto:
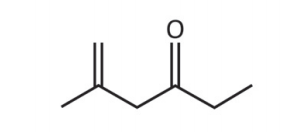
Nesse caso, a estrutura do composto colorido formado será:
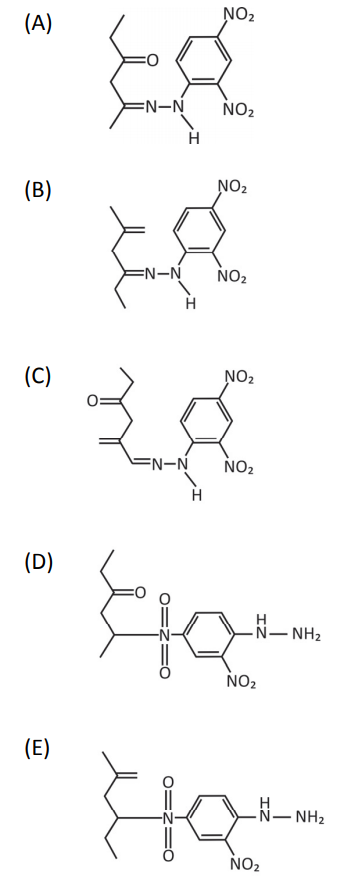
Resolução Comentada
O oxigênio da estrutura 2,4-dinitrofenilhidrazina é retirada dessa molécula e se combina com os hidrogênios do grupo NH2. Assim, anula-se as alternativas A), C) e D). A alternativa D) é incorreta porque a reação não ocorre no grupo nitro do anel benzeno. A reação ocorre pela combinação da carbonila com o grupo amino.
Gabarito: B
Questão 11
Em supermercados, é comum encontrar alimentos chamados de liofilizados, como frutas, legumes e carnes. Alimentos liofilizados continuam próprios para consumo após muito tempo, mesmo sem refrigeração. O termo “liofilizado”, nesses alimentos, refere‐se ao processo de congelamento e posterior desidratação por sublimação da água. Para que a sublimação da água ocorra, é necessária uma combinação de condições, como mostra o gráfico de pressão por temperatura, em que as linhas representam transições de fases.
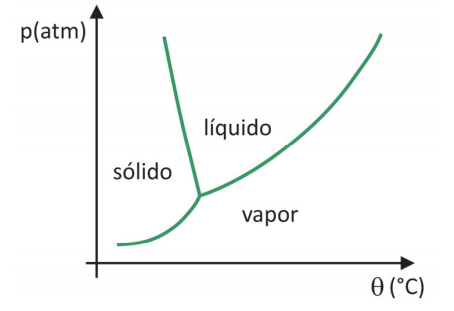
Apesar de ser um processo que requer, industrialmente, uso de certa tecnologia, existem evidências de que os povos pré‐ colombianos que viviam nas regiões mais altas dos Andes conseguiam liofilizar alimentos, possibilitando estocá‐los por mais tempo. Assinale a alternativa que explica como ocorria o processo de liofilização natural:
(A) A sublimação da água ocorria devido às baixas temperaturas e à alta pressão atmosférica nas montanhas.
(B) Os alimentos, após congelados naturalmente nos períodos frios, eram levados para a parte mais baixa das montanhas, onde a pressão atmosférica era menor, o que possibilitava a sublimação.
(C) Os alimentos eram expostos ao sol para aumentar a temperatura, e a baixa pressão atmosférica local favorecia a solidificação.
(D) As temperaturas eram baixas o suficiente nos períodos frios para congelar os alimentos, e a baixa pressão atmosférica nas altas montanhas possibilitava a sublimação.
(E) Os alimentos, após congelados naturalmente, eram prensados para aumentar a pressão, de forma que a sublimação ocorresse.
Resolução Comentadada questão 11 da prova química Fuvest 2020
Julgando os itens, tem-se:
- a) Errado. Em um ambiente de elevada altitude, a pressão atmosférica é baixa.
- b) Errado. Na parte mais baixa da montanha apresenta maior pressão atmosférica do que a parte elevada da montanha.
- c) Errado. A retirada de água do alimento congelado é um processo físico denominado sublimação. A condensação é a passagem do vapor para o estado líquido.
- d) Certo. A água contida nos alimentos congelados expostos à baixas pressões sofrem sublimação, ou seja, passagem do estado sólido para o vapor.
- e) Errado. Se um alimento congelado é pressionado, continuará no estado sólido.
Gabarito: D
Questão 12
Para exemplificar probabilidade, um grupo de estudantes fez uma atividade envolvendo química, conforme o procedimento descrito.
Cada estudante recebeu um recipiente contendo 800 mL de água destilada com algumas gotas do indicador de pH alaranjado de metila e soluções de HCl e NaOH em diversas concentrações. Cada estudante deveria jogar apenas uma vez dois dados, um amarelo e um vermelho, ambos contendo os números de 1 a 6.
- Ao jogar o dado vermelho, o estudante deveria adicionar ao recipiente 100 mL de solução do ácido clorídrico na concentração 10-n mol/L, sendo n o número marcado no dado (por exemplo, se saísse o número 1 no dado, a solução seria de 10-1 mol/L; se saísse 6, a solução seria de 10-6 mol/L).
- Ao jogar o dado amarelo, o estudante deveria executar o mesmo procedimento, mas substituindo o ácido por NaOH, totalizando assim 1,0 L de solução.
- O estudante deveria observar a cor da solução ao final do experimento.
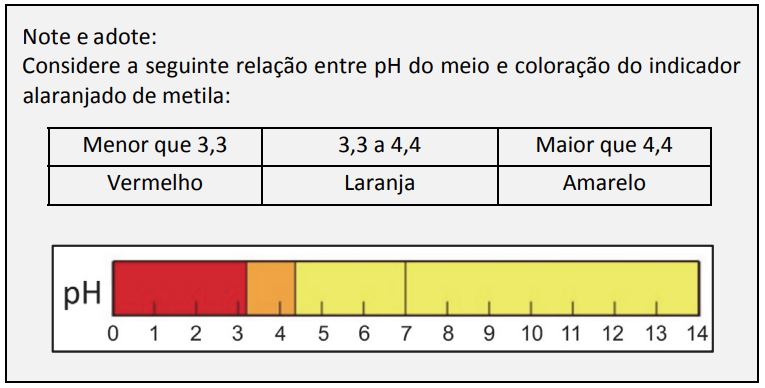
A professora mostrou a tabela com alguns valores de pH resultantes conforme os números tirados nos dados. Ela pediu, então, aos estudantes que utilizassem seus conhecimentos e a tabela para prever em quais combinações de dados a cor final do indicador seria vermelha.
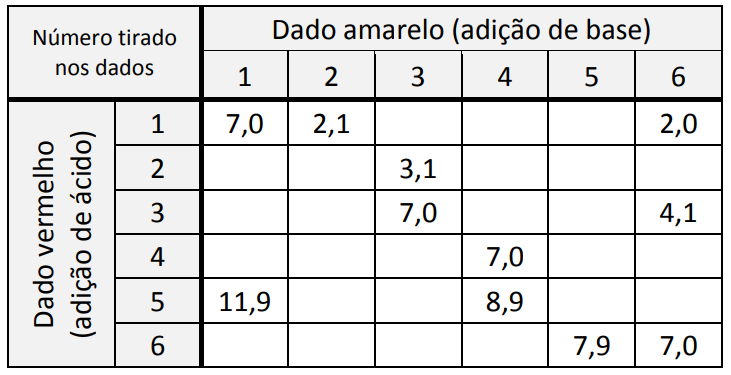
A probabilidade de, após realizar o procedimento descrito, a solução final preparada por um estudante ser vermelha é de:
(A) 1/12
(B) 1/6
(C) 1/4
(D) 11/36
(E) 5/12
Resolução Comentada da questão 12 da prova química Fuvest 2020
Para que o material final apresenta coloração vermelha, a solução final deve apresentar pH igual a 3, ou seja, concentração de H+ igual a 10-3 mol/L. Em 1 litro de solução, é necessário conter 0,001 mol de H+.
Para que seja possível existir 0,001 mol de H+ em solução, é necessária uma quantidade de H+, adicionada inicialmente, maior do que 0,001 para que depois de reagir com a solução básica ainda apresente 0,001 molde H+ no final do experimento.
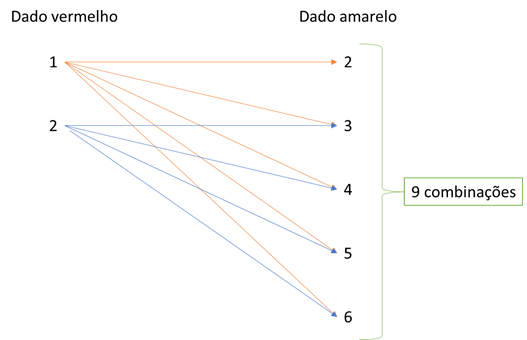
Assim, os dados vermelhos com números 3, 4, 5 e 6 apresentam valores menores que 0,001 mol de H+ e devem ser descartados. Valores aceitos para o dado vermelho: 1 e 2.
O dado amarelo não pode ser igual a 1, porque a quantidade de mols de OH– seria de 0,01 mol de OH– e tornaria a quantidade de íons H+ menor que 0,001 mol. Portanto, o único valor do dado amarelo descartado é o 1. Porém, a combinação do dado vermelho 2 com dado amarelo 2 resulta um pH neutro.
Assim, é possível fazer as seguintes combinações:
1 + 2
Gabarito: C
É isso, pessoal! Espero que tenham curtido a resolução da prova de Química da Fuvest 2020. Sigam-me nas redes sociais. Têm muitas dicas lá. Mande uma mensagem, caso tenha tido alguma dúvida. Abraços!
Instagram: @professorprazeres
Veja também:
Veja também:
- Química geral: o que é e principais assuntos
- Dicas para aprender Química
- Estados da Matéria: o que são e como se transformam
- Tabela Periódica completa e atualizada: histórico, organização, propriedades e mais!
- Gases nobres: tire suas dúvidas!
- Equação de Clapeyron: o que é e como cai no vestibular?
- Equação de Nernst: o que é e como é cobrada em prova
- Destilação simples e fracionada: entenda a diferença
- Acidez e basicidade dos compostos orgânicos: como reconhecer e diferenciar
- Ácidos: o que são, classificações, nomenclatura e muito mais!
- Reações inorgânicas: definição, tipos e questões de vestibular




