Os estados das matérias, as substâncias, os compostos, as misturas e a concentração são alguns dos conceitos da estequiometria que aparecem em todas as edições do Enem. Por isso, é muito importante conhecer e dominar esses assuntos para alcançar um bom desempenho nas provas!
Então, o Estratégia Vestibulares preparou um artigo que resume as principais informações sobre Estequiometria no Enem como os conceitos citados acima, questões relacionadas que já caíram na prova e suas resoluções.”. Acompanhe a seguir!
Navegue pelo conteúdo
O que é Estequiometria?
A estequiometria é o cálculo de quantidades proporcionais em equações químicas. Geralmente são utilizadas equações de primeiro grau para que se alcance o valor da incógnita pedida no enunciado das questões.
Por meio das proporções estequiométricas é possível prever os valores de concentração, o número de mols, a massa, o volume e até mesmo a pressão entre compostos relacionados.
Uma boa representação e explicação para a relação numérica entre as substâncias é a lei da conservação das massas, proposta por Lavoisier no século XVIII. Nessa lei, é considerado que todo o valor de massa presente nos reagentes, estará presente nos produtos. Ou seja, massa dos produtos = massa dos reagentes.
Temas sobre Estequiometria no Enem
No caderno de ciências da natureza do Enem a estequiometria aparece com muita frequência. Ao mesmo tempo, esse tema pode custar muito tempo de resolução, por isso, compreender os fundamentos dos cálculos estequiométricos pode ser crucial para o seu desempenho na prova.
É importante ressaltar, ainda, que a atenção com as unidades de medida devem ser redobradas nessas questões. Lembre-se da lista abaixo, com as grandezas mais recorrentes da estequiometria:
- Condições Naturais de Temperatura e Pressão (CNTP): , cada mol de um gás ocupa 22L à 0º, sob pressão de 1 atm;
- Unidades de massa: 1000g=1kg e 1g=10-3kg; e
- Unidades de volume: 1000ml=1L.
Nos tópicos abaixo, veja resumos sobre as principais grandezas que aparecem nas questões estequiométricas!
Concentração
A concentração é a razão entre a quantidade de um soluto e a quantidade de solvente.
Por exemplo, se a cada 100ml de água existem 10g de açúcar, quantos gramas de açúcar existirão em 350ml de água? A resposta é 35g de açúcar, pois ocorre proporcionalidade entre as partes.
Confira alguns cálculos na imagem abaixo:

Número de mols
O cálculo do número de mols de uma substância em uma equação química pode ser muito importante para determinar a pressão, o deslocamento do equilíbrio e outras constatações. Para encontrar esse valor estequiométrico, é preciso seguir a proporcionalidade da reação. Veja um exemplo na figura abaixo:
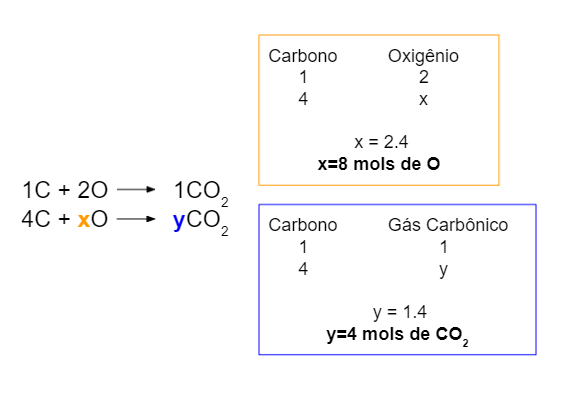
Volume
Determinar o volume de determinado gás ou composto em uma reação química pode ajudar a encontrar os valores de pressão, temperatura e outras variáveis químicas e físicas. Para isso, o cálculo estequiométrico é um grande aliado na proporcionalidade das grandezas.
A CNTP, Condições Naturais de Temperatura e Pressão, determina que o cada mol de um gás ocupa 22L à 0º, sob pressão de 1 atm. Compreenda com o exemplo da imagem:
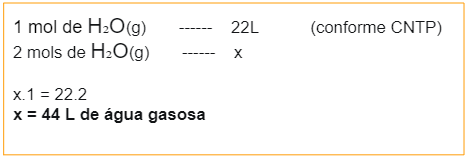
Massa
Encontrar a massa de uma substância é essencial para a estequiometria do Enem, pois esse conteúdo sempre aparece! Para isso, basta saber qual a massa de cada átomo, conforme fornecido na questão e, depois, trabalhar a proporcionalidade. Confira na exemplificação a seguir, que utiliza como base a reação “1C + 2O → 1CO2”.

Questão sobre Estequiometria no Enem
Agora que você já tem as noções fundamentais sobre estequiometria, veja como esse assunto apareceu no Enem dos últimos anos – ao final, confira a resolução proposta pelo time do Estratégia!
ENEM 2017
O ácido acetilsalicílico, AAS (massa molar igual a 180 g/mol), é sintetizado a partir da reação do ácido salicílico (massa molar igual a 138 g/mol) com anidrido acético, usando-se ácido sulfúrico como catalisador, conforme a equação química:
Após a síntese, o AAS é purificado e o rendimento final é de aproximadamente 50%. Devido às suas propriedades farmacológicas (antitérmico, analgésico, anti-inflamatório e antitrombótico), o AAS é utilizado como medicamento na forma de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do texto. Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?
a) 293
b) 345
c) 414
d) 690
e) 828
Conforme determinado pelo texto, existe a proporcionalidade:
138g de ácido salicílico para cada 180g de ácido acetilsalicílico formado.
Apesar disso, o rendimento da reação é de 50%, ou seja, a produção é 50% menor que o esperado.
Para encontrar o valor real de produção, basta multiplicar a massa dos produtos pelo rendimento decimal, que nesse caso é igual a 0,5.
138g de ácido salicílico —– 180.1 (reação de rendimento ideal)
138g de ácido salicílico —– 180.0,5 (reação de rendimento real)
Rendimento real = 90g de ácido acetilsalicílico
Isto é, para cada 138g de ácido salicílico, serão produzidos 90g de ácido acetilsalicílico.
Ao mesmo tempo, cada comprimido contém 500mg de ácido acetilsalicílico e deseja-se fabricar 900 mil comprimidos, o que permite a seguinte construção:
1 comprimido —– 500.10-3 g de AAS
900.103 comprimidos —– x gramas de AAS
Para a resolução, utiliza-se regra de três simples:
x.1 = 500.10-3.900.103 (as potências de dez são anuladas entre si), assim:
x=450000 gramas de AAS = 45 kg de AAS
Agora que foi encontrada a quantidade de AAS necessária para a produção de 900 mil comprimidos, é necessário voltar a proporção inicial e encontrar o valor de ácido salicílico que será utilizado. Acompanhe:
138 g de ácido salicílico —– 90g de AAS
y g de ácido salcílico —– 450000g de AAS
A equação matemática formada será:
450000.138=90.y
(450000.138)/90=y
5000.138=y
y=690000g
Veja que o enunciado pede a resposta quilogramas, unidade de massa que corresponde a 1000 gramas, o que permite inferir que y = 690kg.Dessa forma, para fabricar 900 mil comprimidos, a indústria farmacêutica precisa de 690kg de ácido salicílico, como está descrito na alternativa D.
Veja como o Estratégia Vestibulares pode te ajudar!
Gostou do conteúdo? Então seja um aluno do Estratégia Vestibulares! Visite nossa plataforma e tenha acesso a aulas e materiais elaborados para a sua aprovação!
Clique no banner abaixo:
Veja também:
- O que mais cai em Química Orgânica no Enem?
- Como é cobrada a Separação de Misturas no Enem?
- Eletroquímica no Enem: o que cai?
- Classificações de Química Orgânica para o Enem
- O que cai sobre Equilíbrio Químico no Enem?
- O que cai de Soluções Químicas no Enem?
- Cálculo Estequiométrico: o que é e como calcular!
- Massa molar: o que é, número de mol, como calcular e questões
- Concentração molar: o que é, como calcular e aplicações




