A prova de ciências da natureza do Enem pode ser desafiadora para muitas pessoas. Para amenizar esse sentimento, é importante fundamentar seu conhecimento sobre química, biologia e física. Temas como equilíbrio químico, estequiometria, dinâmica e ecologia são essenciais para sua preparação!
Para te ajudar, o Estratégia Vestibulares preparou um artigo com as principais informações sobre equilíbrio químico como seus gráficos, princípios, cálculos do potencial hidrogeniônico, suas constantes e outros tópicos. Acompanhe a seguir!
Navegue pelo conteúdo
O que é Equilíbrio Químico?
Equilíbrio químico é o conceito usado para reações químicas reversíveis, ou seja, que podem acontecer em sentido direto (→) ou indireto (←). Ele é importante para determinar a velocidade de formação de uma substância conforme as condições de temperatura, pressão e concentração na solução.
Diz-se que uma reação está equilibrada quando as concentrações de reagentes e produtos são constantes e, quando as velocidades do sentido direto e indireto se igualam.
Existe uma constante de equilíbrio Keq, que utiliza números para determinar o sentido das reações e auxiliar na compreensão das interações químicas.
O valor de Keq é calculado com base na concentração de produtos e reagentes no momento em que a reação atinge o equilíbrio. Considere a reação genérica:
A + B ⇋ C + D
Para calcular Keq, utiliza-se a fórmula: Keq=[produtos]/[reagentes], ou seja: Keq=[C].[D]/[A].[B]
Principais temas sobre Equilíbrio Químico no Enem
Agora que você já conhece a definição de equilíbrio químico, aprenda mais sobre os principais temas sobre equilíbrio químico no Enem!
Gráficos do Equilíbrio Químico
Conforme visto anteriormente, no equilíbrio químico, as concentrações de reagentes e produtos ficam constantes. Para representar esse fato graficamente, é preciso considerar que os reagentes são consumidos (diminui a concentração) e os produtos são formados (aumento da concentração). Veja:
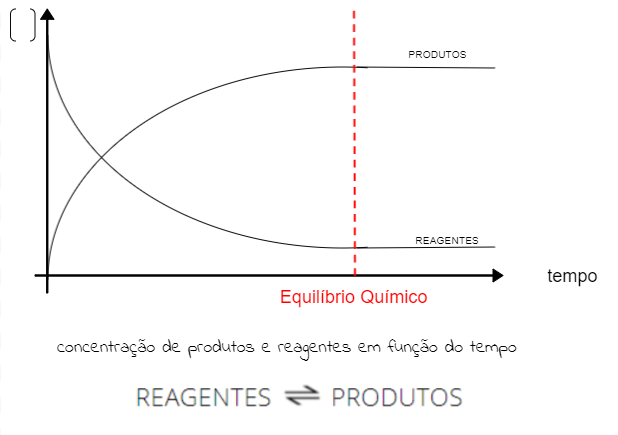
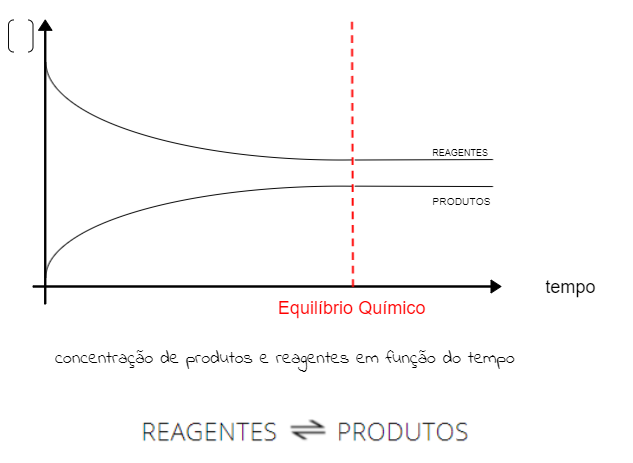
Perceba que alcançar o equilíbrio não se relaciona com os produtos apresentarem maior concentração que os reagentes, apenas que as concentrações devem ser constantes. Graficamente, isso significa que as linhas de concentração estarão paralelas.
Além disso, o equilíbrio químico requer velocidades iguais para os dois sentidos da reação. Nas figuras abaixo, isso será representado por meio de gráficos:
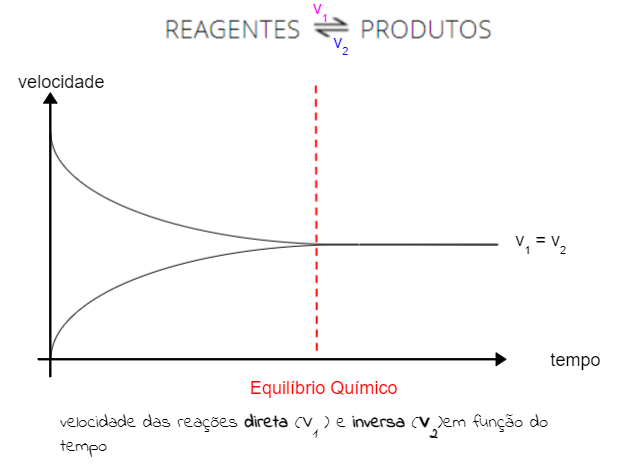
Princípio de Le Chatelier
O princípio de Le Chatelier diz que “quando uma ação externa atua sobre uma reação em equilíbrio, ele [o equilíbrio] será deslocado com o objetivo de minimizar o efeito”. Em termos práticos, isso significa que a reação equilibrada busca manter seu equilíbrio — alterações na concentração, pressão e temperatura são os aspectos mais consideráveis.
pH
A sigla pH indica o potencial hidrogeniônico, que é um valor numérico que dimensiona a acidez ou basicidade de uma substância química. Para isso, o ph representa a quantidade de íons H+ presentes na solução.
Para calcular o valor do pH, deve-se utilizar a fórmula pH=log [H3O+]. Com o resultado em mãos, é importante saber que:
- soluções de pH menor que 7 são ácidas;
- soluções de pH maior que 7 são alcalinas (ou básicas); e
- soluções neutras têm pH igual a 7.
Além disso, é determinado pela química, que a reação entre componentes de pH ácido e compostos de pH alcalino gera a neutralização de ambos os materiais. Veja uma esquematização da reação de neutralização:
Ácido + Base -> Água + Sal
Deslocamento de equilíbrio
Conforme o princípio de Le Chatelier, são propostas algumas leis sobre o deslocamento de equilíbrio, veja na lista abaixo:
- Concentração: aumentar a concentração de uma substância, desloca o equilíbrio para o gasto dela. Já diminuir a concentração da substância, desloca o equilíbrio para repor o que foi retirado;
- Temperatura: o aumento da temperatura favorece o sentido endotérmico da reação, enquanto as temperaturas abaixadas deslocam o equilíbrio para o sentido exotérmico; e
- Pressão: a pressão elevada desloca o equilíbrio para o lado com menor soma dos mols, a pressão rebaixada inclina o equilíbrio para o lado com maior soma total do número de mols.
Constante de ionização
A constante de ionização, ou Ki, é uma forma de expressar a constante de equilíbrio em soluções iônicas.
Geralmente, quanto maior o Ki, mais forte será o ácido e a base. Para obter o valor, deve ser ponderado se a mistura é ácida ou alcalina e, depois, efetuar os cálculos:
- Ácidos: HA ⇋ H+ + A– Ki= [H+].[ A–]/[HA]; e
- Bases: BOH ⇋ B+ + OH– Ki= [B+].[ OH–]/[BOH].
Hidrólise salina
A hidrólise salina é um importante tópico de assunto para o Enem. Em termos gerais, ela trata sobre a reação entre um sal e a água, de forma que produza um ácido e uma base.
Uma reação genérica que representa esse tema é A+B– + H+–OH– ⇋ HB + AOH.
Note que essa reação pode apresentar pHs diferentes, dado que pode gerar ácidos e bases fortes ou fracos.
Mapa mental sobre Equilíbrio Químico para o Enem
O mapa mental abaixo, desenvolvido pelo Estratégia Vestibulares, reúne os tópicos desse texto de forma lúdica e didática, confira:
Equilíbrio Químico Enem questões
ENEM 2012
Uma dona de casa acidentalmente deixou cair na geladeira a água proveniente do degelo de um peixe, o que deixou um cheiro forte e desagradável dentro do eletrodoméstico. Sabe-se que o odor característico de peixe se deve às aminas e que esses compostos se comportam como bases.
Na tabela são listadas as concentrações hidrogeniônicas de alguns materiais encontrados na cozinha, que a dona de casa pensa em utilizar na limpeza da geladeira.
| Material | Concentração de H3O+ (mol/L) |
| Suco de Limão | 10-2 |
| Leite | 10-6 |
| Vinagre | 10-3 |
| Álcool | 10-8 |
| Sabão | 10-12 |
| Carbonato de Sódio/Barrilha | 10-12 |
Dentre os materiais listados, quais são apropriados para amenizar esse odor?
a) Álcool ou sabão.
b) Suco de limão ou álcool.
c) Suco de limão ou vinagre.
d) Suco de limão, leite ou sabão.
e) Sabão ou carbonato de sódio/barrilha.
O enunciado cita que “o odor característico de peixe se deve às aminas e que esses compostos se comportam como bases”. Com isso, deve-se lembrar que a neutralização química de um composto alcalino requer uma substância ácida.
Dessa forma, todos os compostos de ph<7 devem ser considerados. Como pH=log [H3O+], observa-se que:

Conforme as alternativas possíveis, assume-se que a única opção viável é a letra C.
Conheça o conteúdo exclusivo do Estratégia!
Vai prestar vestibulares e a química te assusta? Seja um aluno do Estratégia Vestibulares! Na nossa plataforma você terá acesso a aulas e materiais elaborados para melhorar seu desempenho!
Clique no banner abaixo:
Veja também:
- O que mais cai em Química Orgânica no Enem?
- Como é cobrada a Separação de Misturas no Enem?
- O que cai de Soluções Químicas no Enem?
- Eletroquímica no Enem: o que cai?
- Classificações de Química Orgânica para o Enem
- O que cai de Soluções Químicas no Enem?
- Cinética química: definição, fórmulas e aplicações
- Estequiometria no Enem: como aparece?
- Cálculo Estequiométrico: o que é e como calcular!
- Massa molar: o que é, número de mol, como calcular e questões
- Concentração molar: o que é, como calcular e aplicações




