Olá, meus queridos… Tudo bem? Prof. Prazeres para resolver a prova de química da 2ª Fase do Vestibular da FUVEST 2020. Nesta página, você vai conferir os meus comentários e ainda vai poder baixar a resolução de todas as questões em PDF. Vamos nessa??
Navegue pelo conteúdo
Questão 01
As concentrações de alguns íons em amostras de água estão representadas nos gráficos a seguir. A origem de cada amostra (1, 2 e 3) foi omitida, mas pode corresponder a: amostra de água do mar; amostra de água de chuva numa região costeira; amostra de água doce de rio.
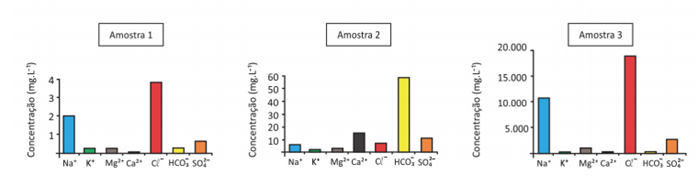
a) O bicarbonato na água pode vir de diferentes fontes. Cite uma fonte de bicarbonato comum às três amostras.
b) Preencha a tabela da folha de respostas com a correspondência entre as amostras 1, 2 e 3 e o ambiente em que foram coletadas.
c) É esperado que a concentração de íons cloreto na água coletada da chuva em um ambiente continental seja igual, maior ou menor à de ambientes costeiros (ambos sem poluição)? Justifique sua resposta.
Gabarito
a) A fonte comum de bicarbonato a todas as amostras é o ar atmosférico que apresenta CO2 (g) que, ao entrar em contato com a água da atmosfera, sofre as seguintes transformações:
b)
| Ambiente | Água do mar | Água de chuva em região costeira | Água doce de rio |
| Amostra | 3 | 1 | 2 |
c) A concentração de íons cloreto na água da chuva das amostras é igual, porque o íon cloreto é encontrado na forma iônica. Os compostos iônicos apresentam elevadíssima temperatura de fusão e ebulição, logo, não sofrem vaporização. A concentração de cloreto nas amostras é nula.
Questão 02
O experimento conhecido como “chuva de ouro” consiste na recristalização, à temperatura ambiente, de iodeto de chumbo (PbI2). A formação desse sal pode ocorrer a partir da mistura entre nitrato de chumbo (Pb(NO3)2) e iodeto de potássio (KI). Outro produto dessa reação é o nitrato de potássio (KNO3) em solução aquosa.
Tanto o Pb(NO3)2 quanto o KI são sais brancos solúveis em água à temperatura ambiente, enquanto o PbI2 é um sal amarelo intenso e pouco solúvel nessa temperatura, precipitando como uma chuva dourada.
Em um laboratório, o mesmo experimento foi realizado em dois frascos. Em ambos, 100 mL de solução 0,1 mol.L‐1 de Pb(NO3)2 e 100 mL de solução 0,2 mol.L‐1 de KI foram misturados. Ao primeiro frasco foi também adicionado 20 mL de água destilada, enquanto ao segundo frasco foi adicionado 20 mL de solução 0,1 mol.L‐1 de iodeto de sódio (NaI).
A tabela a seguir apresenta os dados de solubilidade dos produtos da reação em diferentes temperaturas.

Responda aos itens a seguir considerando os dados do enunciado e o equilíbrio químico de solubilidade do iodeto de chumbo:
a) Indique se o procedimento do segundo frasco favorece ou inibe a formação de mais sólido amarelo.
b) Para separar o precipitado da solução do primeiro frasco e obter o PbI2 sólido e seco, foi recomendado que, após a precipitação, fosse realizada uma filtração em funil com papel de filtro, seguida de lavagem do precipitado com água para se retirar o KNO3 formado e, na sequência, esse precipitado fosse colocado para secar. Nesse caso, para se obter a maior quantidade do PbI2, é mais recomendado o uso de água fria (4 °C) ou quente (80 °C)? Justifique.
c) Encontre a constante do produto de solubilidade (KPS) do iodeto de chumbo a 32 °C.
Gabarito
a) O aumento da concentração de iodeto desloca o equilíbrio iônico para o sentido de formação do precipitado.
b) Segundo a tabela fornecida, quanto maior a temperatura da água, maior a solubilidade do sal. Para obter maios quantidade de PbI2 deve-se evitar a sua dissolução em água quente. Portanto, deve-se utilizar água fria para diminuir a quantidade de íons dissolvidos na solução.
c) PbI2 a 32 °C apresenta a solubilidade de 0,922 g/L.
Primeiramente, converte-se 0,922 g/L para mol/L, sabendo que a massa molar do PbI2 é igual a 461 g/mol:
Sabe-se que para cada S mol de PbI2 dissociado, forma-se S mol de Pb2+ e 2S de I–.
Para
Questão 03
O médico Hans Krebs e o químico Feodor Lynen foram laureados com o Prêmio Nobel de Fisiologia e Medicina em 1953 e 1964, respectivamente, por suas contribuições ao esclarecimento do mecanismo do catabolismo de açúcares e lipídios, que foi essencial à compreensão da obesidade. Ambos lançaram mão de reações clássicas da Química Orgânica, representadas de forma simplificada pelo esquema que mostra a conversão de uma cadeia saturada em uma cetona, em que cada etapa é catalisada por uma enzima (E) específica:
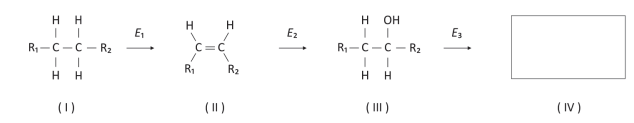
a) Complete, no espaço determinado na folha de respostas, a fórmula estrutural do produto (IV) formado pela oxidação do álcool representado na estrutura (III).
b) Identifique pelo número qual das espécies (I, II ou III) possui isomeria geométrica (cis ‐ trans) e desenhe os isômeros. c) Se R1 e R2 forem cadeias carbônicas curtas, os compostos representados por(III)serão bastante solúveis em água, enquanto que, se R1 e/ou R2 forem cadeias carbônicas longas, os compostos representados por (III)serão pouco solúveis ou insolúveis em água. Por outro lado, os compostos representados por (I) e (II) serão pouco solúveis ou insolúveis em água independentemente do tamanho das cadeias. Explique a diferença do comportamento observado entre as espécies(I) e (II) e a espécie (III).
Note e adote:
Considere R1 e R2 como cadeias carbônicas saturadas diferentes, contendo átomos de carbono e hidrogênio.
Gabarito
a)
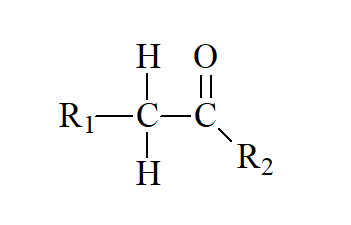
b)

c) Os compostos I e II são hidrocarbonetos, logo, são apolares e pouco solúveis em água.
O composto III de pequena cadeia carbônica apresenta pequena apolaridade quando comparada a polaridade do grupo hidroxila, que realiza interações polares do tipo ligação de hidrogênio. Devido à ligação de hidrogênio provocada pelo grupo hidroxila, o composto III é solúvel em água.
Questão 04
O lítio foi identificado no século XIX a partir das observações do naturalista e estadista brasileiro José Bonifácio de Andrada e Silva. Em 2019, esse elemento ganhou destaque devido ao Prêmio Nobel de Química, entregue aos pesquisadores John Goodenough, Stanley Whittingham e Akira Yoshino pelas pesquisas que resultaram na bateria recarregável de íon lítio. Durante o desenvolvimento dessa bateria, foi utilizado um eletrodo de CoO2(s) (semirreação I) em conjunto com um eletrodo de lítio metálico intercalado em grafita (LiC6(s)) (semirreação II) ou um eletrodo de lítio metálico (Li(s)) (semirreação III).
(I) CoO2(s) + Li+ (aq) + 1e– → LiCoO2(s) E° = + 1,00 V
(II) Li+ (aq) + C6(s) + 1e– → LiC6(s) E° = ‐ 2,84 V
(III) Li+ (aq) + 1e– → Li(s) E°= ‐ 3,04 V
Considerando essas semirreações:
a) Escreva a reação global da bateria que utiliza o lítio metálico como um dos eletrodos.
b) Indique qual dos dois materiais, lítio metálico ou lítio metálico intercalado em grafita, será um agente redutor mais forte. Justifique com os valores de potencial de redução padrão.
Em 1800, José Bonifácio descobriu o mineral petalita, de fórmula XAlSi4O10 (na qual X é um metal alcalino). Em 1817, ao assumir que X = Na, o químico sueco Johan Arfwedson observou que a petalita apresentaria uma porcentagem de metal alcalino superior ao determinado experimentalmente. Ao não encontrar outros substitutos conhecidos que explicassem essa incongruência, ele percebeu que estava diante de um novo elemento químico, o Lítio (Li).
c) Explique, mostrando os cálculos, como a observação feita por Arfwedson permitiu descobrir que o elemento novo era o Lítio.
Note e adote:
Massas molares (g.mol-1): Li = 7; O = 16; Na = 23; Al = 27; Si = 28.
% em massa de Al na petalita: 8,8%
Gabarito
a) redução: CoO2 (s) + Li+ (aq) + e- → LiCoO2 (s)
Oxidação: Li (s) → Li+ (aq) + 1e–
Reação global: CoO2 (s) + Li (s) → LiCoO2 (s)
b) O agente redutor é a espécie química que provoca a redução, ou seja, que sofre oxidação. A espécie que apresenta maior tendência a sofrer oxidação é aquela que apresenta o maior potencial de oxidação. Potenciais de oxidação:
Li (s) Eoxi = + 3,04 V | LiC6 (s) Eoxi = +2,84 V
Assim, o agente redutor mais forte é o Li(s) porque apresenta o maior potencial de oxidação (+ 3,04 V).
c) A porcentagem da massa de alumínio na fórmula XAlSi4O10 é igual a 8,8%, calcula-se a massa de 100%:
Sabe-se que massa molar da substância é igual a 306,8 g/mol, portanto, calcula-se a massa molar de X:
MX + Al + 4 · Si + 10 · 16 = 306,8 g/mol
MX + Al + 4 · Si + 10 · O = 306,8 g/mol
MX + 27 g/mol + 4 · 28 g/mol + 10 · 16 g/mol = 306,8 g/mol
MX = 7,8 ≈ 8 g/mol (que é a massa molar do lítio)
Questão 05
Arla 32 é uma solução de aproximadamente 32 g de ureia (H2NCONH2) em 100 mL de água utilizada em veículos a diesel para diminuir as emissões de óxidos de nitrogênio (NO e NO2), que podem causar problemas ambientais quando em excesso na atmosfera. A solução de Arla, ao ser adicionada aos gases de escape do motor, em alta temperatura, forma amônia (reação I). Em uma segunda etapa, a amônia formada reage com NO2 e gera gás nitrogênio e água (reação II).
(I) H2NCONH2(aq) + H2O (l) → 2 NH3(g) + CO2(g)
(II) 8 NH3(g) + 6 NO2(g) → 7 N2(g) + 12 H2O(g)
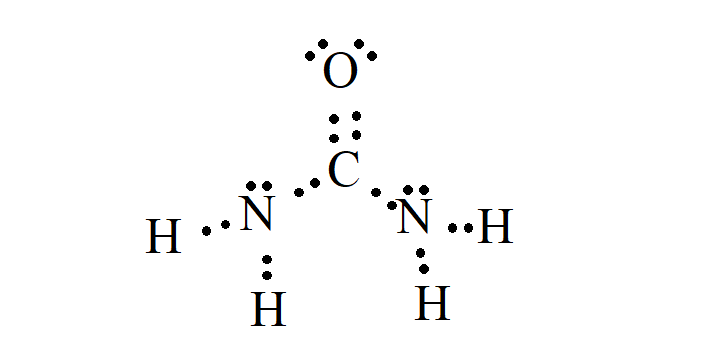
a) Escreva a fórmula de Lewis da ureia.
b) Calcule quantos litros de solução de Arla 32 são necessários para consumir todo o NO2 produzido em uma viagem de 100 km, considerando que a quantidade de NO2 formado por esse veículo é de 460 mg por km rodado. Indique os cálculos.
c) Considerando que a reação entre NH3 e NO forma os mesmos produtos que a reação II, o volume gasto de Arla 32 para consumir o NO seria menor, igual ou maior ao usado para consumir uma mesma quantidade em mol de NO2? Justifique mostrando a reação entre NH3 e NO.
Note e adote:
Considerar todas as reações com 100% de rendimento.
Massas molares: ureia = 60 g.mol-1; NO2 = 46 g.mol-1
Distribuição eletrônica: H: 1s1; C: 1s22s22p2;N: 1s22s22p3; O:1s22s22p4
Gabarito
a)
b) Calcula-se a massa de NO2 consumida durante o deslocamento de 100 km:
Determina-se a reação global entre ureia e NO2:
Reação global:
A proporção, em mol, da reação entre ureia (massa molar igual a 60 g/mol) e NO2 (massa molar igual a 46 g/mol) é de 4 mol de CO(NH2)2 para 6 mol de NO2 (ou 2 para 3). Calcular-se a massa de CO(NH2)2 consumida por 46 g de NO2:
Calcula-se o volume da solução de Arla 32 que contenha 40 g de CO(NH2)2:
y = 125 mL = 0,125 mL
c) A reação balanceada entre NH3 e NO é:
4 NH3 + 6 NO → 5 N2 + 6 H2O
Determina-se a reação global entre CO(NH2)2 e NO:
Reação Global:
Compara-se as duas reações globais:
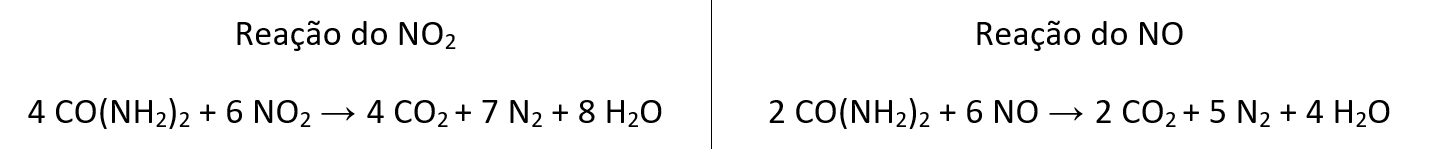
Percebe-se que, para o mesmo número de mols de NO e NO2, ocorre menor consumo de ureia pela solução de NO do que pela solução de NO2.
Questão 06
Muitos metais (Mn+) em água, dependendo do pH da solução, formam hidróxidos (M(OH)n) insolúveis. Esse comportamento pode ser descrito pela equação (I), que relaciona o valor de pH com o logaritmo da concentração do metal (log [Mn+]), para uma dada temperatura, em que KPS é a constante do produto de solubilidade do hidróxido do metal.
Equação (I): log[Mn+] = log(KPS) + 14n – n(pH)
O comportamento da equação (I) é representado no gráfico, no qual as linhas mostram o valor de pH e log[Mn+] em que se inicia a precipitação de cada um dos metais. Em condições mais alcalinas do que a apresentada na linha de cada metal, será observada a espécie insolúvel como hidróxido e, em condições mais ácidas do que a apresentada na linha, será observada a espécie em sua forma solúvel.
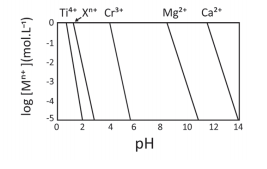
a) Pinte, no gráfico da folha de respostas, a região onde o Cr3+ se encontra na forma solúvel e o Ti4+ se encontra na forma de Ti(OH)4 insolúvel.
b) As linhas que representam Mg2+ e Ca2+ possuem a mesma inclinação, mas diferem da inclinação das linhas que representam Cr3+ e Xn+, que possuem a mesma inclinação entre si. Indique a carga n de Xn+ e justifique com base na equação (I).
c) Indique qual das espécies tem maior valor de KPS: Ca(OH)2 ou Mg(OH)2. Justifique com base nas informações dadas.
Gabarito
a)
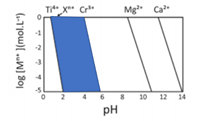
b) Observando a equação, percebe-se que o coeficiente angular da função em relação ao pH é a incógnita n.

Tanto a reta de Xn+ e Cr3+ apresentam a mesma inclinação, ou seja, o mesmo coeficiente angular que é o n. Assim, conclui-se que ambos apresentam o mesmo valor de n. A valência de Cr3+é +3, logo, Xn+ será X3+.
c) Compara-se dois pontos no gráfico de Mg2+ e Ca2+:
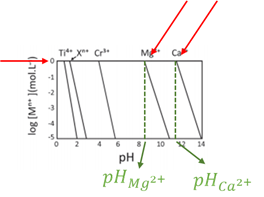
Sabe-se que para log [Mn+] = 0 para ambas as retas, tem-se:
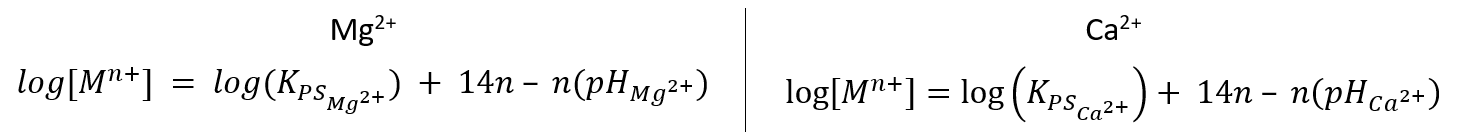
Sabe-se que , logo,
Resolução FUVEST 2020 – 2ª fase – Química
Instagram: @professorprazeres

Veja também:
- Química geral: o que é e principais assuntos
- Quimiossíntese: entenda como funciona o processo
- Termoquímica: reações endotérmicas e exotérmicas
- Polímeros: conceito, classificação, propriedades e reações químicas
- Funções oxigenadas: conceitos, usos e exemplos
- Números quânticos: quais são e como determinar
- Ciclo do Nitrogênio: o que é, como funciona e sua importância
- Cadeia Carbônica: o que é, como classificar e questões de vestibular
- Energia de ionização do Oxigênio e do Nitrogênio: qual a menor?
- Resolução Comentada Prova de Química Fuvest 2020



