Quando falamos no tema “ácidos”, é comum se lembrar de alimentos como limões, laranjas e abacaxis. Muito além de alguns sabores clássicos, eles são substâncias químicas estudadas quanto ao seu comportamento em meio aquoso, suas reações com bases e sua função na formação dos sais.
Continue lendo e saiba mais sobre as características dos ácidos, quais são as teorias por trás desses compostos químicos, qual a nomenclatura padrão utilizada, entre outras informações essenciais para o conhecimento pré-vestibular. Acompanhe, ao final, a resolução e gabarito de uma questão do Enem sobre esse tema.
Navegue pelo conteúdo
Teorias químicas para definição de ácidos
Para determinar se uma substância tem características ácidas ou básicas, foram estipuladas algumas teorias, que auxiliam na compreensão desses compostos químicos. Acompanhe, a seguir, o que são estes compostos a partir das ideias de Arrhenius, Bronsted-Lowry e Lewis.
Teoria de Arrhenius
Na teoria de Arrhenius, os compostos ácidos são capazes de doar um próton de hidrogênio (H+). Ao passo que os básicos são aqueles que liberam OH– (ânion hidroxila) nas reações químicas.
Teoria de Bronsted-Lowry
Segundo a teoria de Bronsted-Lowry, ainda temos a ideia de que os ácidos são os compostos que liberam prótons H+ no meio. Entretanto, nesse caso, as bases são aquelas substâncias que recebem esses prótons do entorno.
Teoria de Lewis
A teoria ácido-base de Lewis traz novos conceitos: os ácidos são aqueles que aceitam pares eletrônicos do meio em que estão inseridos. Do lado oposto, as substâncias básicas são as responsáveis pela doação de elétrons.
Diferença entre ácidos e bases
Para reforçar a ideia da diferença entre ácidos e bases, entenda o diagrama da imagem abaixo. A letra “A” é utilizada para representar os ácidos, e “B” são símbolos para as bases — ou mesmo as hidroxilas e os prótons H+.
Perceba que, cada teoria tem um pouco das ideias utilizadas na anterior, por isso estão em círculos “um dentro do outro”.
Características dos ácidos
Entre as primeiras características, podemos citar seu potencial hidrogeniônico (pH), que deve estar sempre no intervalo 1<pH ácido<7.
Essa graduação é dada de forma que quanto mais próximo de 7, menor a propriedade ácida. Ao mesmo tempo, quanto menor o valor do pH, mais ácida é a substância.
O odor liberado pelos ácidos é forte, e seu sabor é classicamente azedo ou amargo. Em termos físico-químicos, ele tem pontos de fusão e ebulição baixos.
Em meio aquoso, as substâncias ácidas atuam de forma a favorecer a condução de corrente elétrica.
Nomenclatura dos ácidos
O primeiro termo do nome de um ácido será, justamente, a palavra ácido. Depois, eles serão divididos em dois grandes grupos, como você pode ver nos tópicos abaixo.
Hidrácidos
Hidrácidos são compostos que não possuem átomos de oxigênio em suas moléculas. A nomenclatura adotada nesses casos é a seguinte:
ácido + nome do ânion + sufixo ídrico
| Ânion | Nome do ácido |
| Cloreto | Ácido clorídrico |
| Fluoreto | Ácido fluorídrico |
| Brometo | Ácido bromídrico |
Oxiácidos
Os oxiácidos dependem do número de oxidação (Nox) do elemento central, já que geralmente teremos três elementos químicos entremeados na molécula.
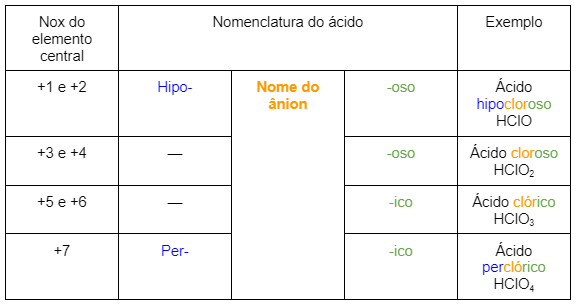
Compostos ácidos famosos
- Ácido carbônico (H2CO3): no dia a dia, esse ácido está presente nos refrigerantes e bebidas gaseificadas. Eles ajudam na sensação de refrescância causada por esses preparos;
- O bórico (H3BO3): utilizado, principalmente, para a desinfecção de feridas e lesões na pele. Atua como antisséptico, combatendo alguns fungos e bactérias;
- Ácido ascórbico (C6H8O6): é um composto orgânico de caráter ácido conhecido como vitamina C. Presente principalmente em frutas cítricas, como laranja, limão e acerola, essa substância é um importante antioxidante para o corpo humano;
- O acético (CH3COOH): também orgânico, o ácido acético é um dos principais componentes do vinagre, tão importante para a alimentação humana, presente em alguns produtos químicos caseiros e até mesmo como desinfectante;
- Ácido fosfórico (H3PO4): presente em fertilizantes do solo, é um importante aliado da agricultura. Também pode estar presente em formulações farmacêuticas conhecidas.
Questão do Enem:
ENEM 2013
A formação frequente de grandes volumes de pirita (FeS2) em uma variedade de depósitos minerais favorece a formação de soluções ácidas ferruginosas, conhecidas como “drenagem ácida de minas”. Esse fenômeno tem sido bastante pesquisado pelos cientistas e representa uma grande preocupação entre os impactos da mineração no ambiente. Em contato com oxigênio, a 25°C, a pirita sofre reação, de acordo com a equação química:
4 FeS2 (s) + 15 O2 (g) + 2 H2O (l) → 2 Fe2(SO4)3 (aq) + 2 H2SO4 (aq)
FIGUEIREDO. B. R. Minérios e Ambientes. Campinas. Unicamp. 2000.
Para corrigir os problemas ambientais causados por essa drenagem, a substância mais recomendada a ser adicionada ao meio é o
a) sulfeto de sódio.
b) cloreto de amônio.
c) dióxido de enxofre.
d) dióxido de carbono.
e) carbonato de cálcio.
O texto aborda uma problemática ambiental: os impactos da mineração para o meio ambiente. Segundo as informações químicas concedidas pelo enunciado, um dos resultados da mineração é a liberação de ácido sulfúrico (H2SO4) em formato aquoso, que pode ser drenado no solo, por exemplo.
Em primeira instância, o composto que deve ser utilizado para solucionar essa questão precisa ser neutralizante das características ácidas. Nesse sentido, podemos pensar na função inorgânica diretamente oposta aos ácidos: as bases.
Nas alternativas apresentadas, temos alguns compostos ácidos ou derivados. A melhor afirmativa seria um sal que possua uma propriedade alcalina, isto é, derivado de uma base forte em reação com um ácido fraco.
Observa-se, portanto, que a única opção que se enquadra nessas circunstâncias é a letra E.
Questões ambientais nos vestibulares
As questões ambientais, por muitas vezes, são temas das provas de vestibulares. Entre os assuntos mais tratados, sabemos que as substâncias químicas podem impactar diretamente o meio ambiente — inclusive os agrotóxicos. Veja a aula gratuita da Coruja sobre isso!
Estude mais de química com a Coruja!
A banca de provas da sua faculdade dos sonhos tem testes com primeira e segunda fase? O Estratégia Vestibulares pode te ajudar! Nossos simulados são construídos com base no seu modelo de prova, com gabarito e correção, inclusive para os exercícios discursivos da segunda fase. Clique no banner e saiba mais.
Veja também:
- Química geral: o que é e principais assuntos
- Dicas para aprender Química
- Estados da Matéria: o que são e como se transformam
- Tabela Periódica completa e atualizada: histórico, organização, propriedades e mais!
- Gases nobres: tire suas dúvidas!
- Equação de Clapeyron: o que é e como cai no vestibular?
- Equação de Nernst: o que é e como é cobrada em prova
- Destilação simples e fracionada: entenda a diferença
- Funções inorgânicas: o que são ácidos, bases, sais e óxidos?
- Acidez e basicidade dos compostos orgânicos: como reconhecer e diferenciar
- Reações inorgânicas: definição, tipos e questões de vestibular




