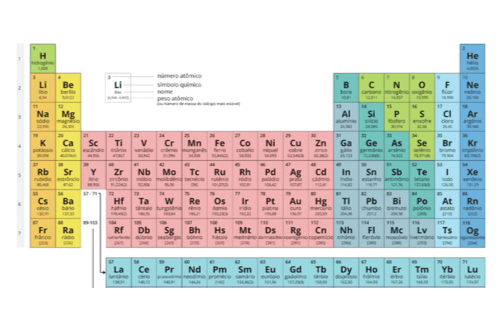
A forma como os elementos são organizados na tabela periódica, em ordem crescente de número atômico, faz com que certas propriedades dos elementos, como raio atômico e eletronegatividade, sigam um padrão na tabela. E isso acontece também com a energia de ionização.
A energia de ionização é definida como a energia necessária para retirar um elétron da camada de valência de um átomo na fase gasosa. Na forma que a tabela foi organizada, a variação dessa energia segue a seguinte tendência:
aumenta conforme o aumento da família e conforme a diminuição do período, ou seja, quanto maior a família e menor o período em que o elemento está, maior sua energia de ionização.
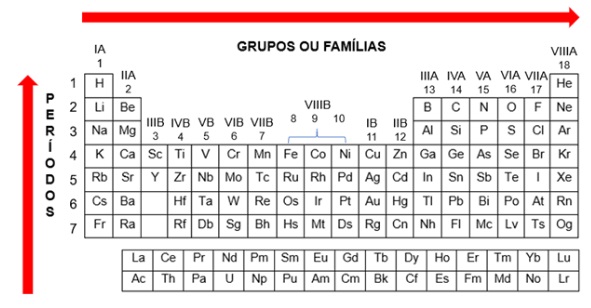
Contudo, em algumas partes da tabela ocorrem inversões nessa regra. Um exemplo dessa situação é a comparação entre as energias de ionização do nitrogênio e do oxigênio. De acordo com a regra, a energia de ionização do oxigênio deveria ser maior, mas isso não ocorre na prática.
Tal inversão ocorre devido a influência da simetria na distribuição de elétrons da última camada do nitrogênio. Vamos comparar os orbitais de valência do oxigênio e do nitrogênio para entender melhor:
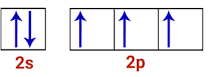
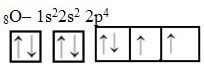
Distribuições eletrônicas da camada de valência do nitrogênio e do oxigênio, respectivamente. Assim, podemos ver que o subnível de valência do nitrogênio (2p) apresenta uma simetria que não aparece no oxigênio, que possui o mesmo subnível de valência, mas com 4 elétrons.
Essa simetria existente na distribuição do nitrogênio o torna mais estável que o oxigênio, e faz com que sua energia de ionização seja maior.
Veja também:
- Quimiossíntese: entenda como funciona o processo
- Termoquímica: reações endotérmicas e exotérmicas
- Polímeros: conceito, classificação, propriedades e reações químicas
- Funções oxigenadas: conceitos, usos e exemplos
- Números quânticos: quais são e como determinar
- Ciclo do Nitrogênio: o que é, como funciona e sua importância
- Cadeia Carbônica: o que é, como classificar e questões de vestibular
- Tabela periódica completa e atualizada
- Resolução Comentada Prova de Química Fuvest 2020
- Resolução da prova de Química da 2ª Fase da Fuvest 2020