Você já se perguntou como é possível que existam tantos compostos químicos com características diferentes? Saiba então que foi a partir desses questionamentos sobre a estrutura da matéria que surgiram os modelos atômicos.
Compreender as teorias atômicas propostas ao longo do tempo é importante para entender o histórico desse tema. Para te ajudar com isso, o Estratégia preparou um artigo que resume a trajetória dos modelos atômicos desde sua descoberta até a atualidade.
No decorrer desse texto, você encontrará afirmações retiradas de uma questão que caiu na prova da Academia Militar das Agulhas Negras, no ano de 2011. Elas serão discutidas para te ajudar a construir um raciocínio de prova. Confira!
Navegue pelo conteúdo
O que é um modelo atômico?
Os modelos atômicos são formas de tentar compreender o átomo e as partes que o compõem. Eles começaram a surgir desde a era pré-socrática e vêm sendo aprimorados com o passar do tempo — de maneira que os conhecimentos adquiridos evoluem e permitem alcançar novas tecnologias.
O átomo
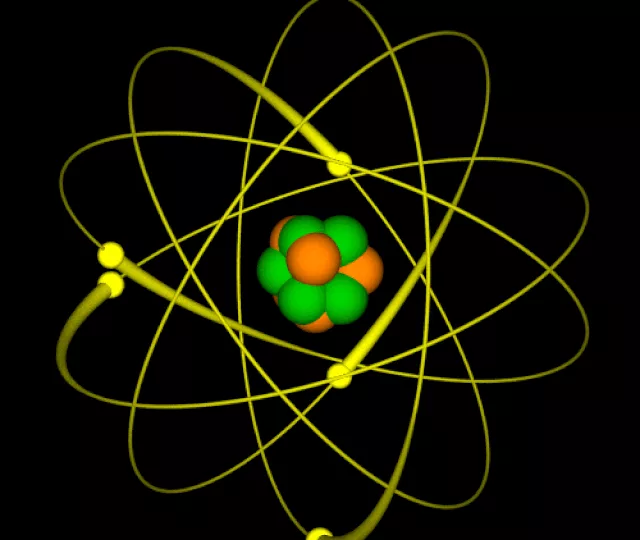
O átomo é a menor unidade que compõe a matéria. Sendo assim, é o ponto comum entre todas as substâncias e corpos existentes: os seres humanos, os objetos, a Terra, o ar, a água, os vegetais, as rochas, todos são construídos a partir de numerosos átomos.
Os primeiros estudiosos que pensaram sobre o assunto foram os filósofos pré-socráticos Leucipo e Demócrito. Sem comprovação científica metodológica, eles afirmavam que a matéria não poderia ser dividida infinitamente: havia um “limite para sua pequenez”.
Para representar essa ideia, o vocábulo átomo foi admitido, com o significado grego de a (não) + tomo (partes) — “aquilo que não tem partes”. Posteriormente, estudiosos do século XIX se voltaram para essa teoria e começaram a testar hipóteses sobre o assunto, como você acompanha no tópico a seguir.
Principais modelos atômicos
John Dalton

Por volta de 1800 d.C., o químico John Dalton retomou o estudo sobre a estrutura da matéria. Assim como os estudiosos anteriores a ele, Dalton apontava para um átomo indivisível e indestrutível.
Em seu modelo atômico, ele adicionou os seguintes elementos:
- A unidade estrutural da matéria eram esferas neutras e maciças, como bolas de bilhar;
- Átomos de um mesmo elemento possuem características exatamente iguais;
- As esferas atômicas possuem massa quantificável; e
- A transformação química acontece quando a posição das esferas se reorganiza na estrutura.
Com base nas informações descritas anteriormente, você classificaria a afirmação seguinte como verdadeira ou falsa?
“No modelo de Dalton, o átomo é dividido em prótons e elétrons.”
A frase é falsa e já podemos te explicar o porquê: no modelo atômico de Dalton, o átomo é uma esfera maciça, indivisível e indestrutível. Nesse caso, não havia espaço para as partículas subatômicas como os prótons, nêutrons e elétrons.
Joseph J. Thomson: o pai do elétron
O modelo atômico de Thomson foi o primeiro a propor uma divisibilidade para o átomo. Tais conclusões estavam baseadas em um experimento de Thomson: raios catódicos eram direcionados a um tubo com eletrodos positivos e negativos.
A trajetória dos raios provou a existência de partículas negativas no átomo. Como as matérias apresentam carga neutra, ele pressupôs que haveriam cargas positivas equilibrando a eletroquímica.
Portanto, para esse estudioso essas são as características atômicas:
- Esfera não maciça com carga elétrica positiva;
- Ao redor dessa esfera, estão dispostas uniformemente partículas de carga negativa;
- A soma das cargas positivas e negativas resulta em uma eletricidade neutra para o átomo; e
- A disposição das partículas componentes do átomo possuíam o formato de um pudim de passas, como mostra a figura abaixo.
Perceba que o modelo proposto por Thomson refutou as ideias propostas por John Dalton. Além disso, foi a primeira vez que o elétron foi notado pelos cientistas — Joseph J. Thomson é o pai do elétron.
Agora que você já conhece o modelo atômico de Thomson, por quais motivos você diria que a frase a seguir é incorreta?
“O físico inglês Thomson afirma, em seu modelo atômico, que um elétron, ao passar de uma órbita para outra, absorve ou emite um quantum (fóton) de energia.”
Veja: a partir de suas observações com os raios catódicos, ele observou que existiam partículas com cargas negativas no átomo. Apesar disso, sua teoria não explicava a emissão de fótons ou a presença da eletrosfera com suas órbitas. Por isso, a afirmativa é falsa.
Ernest Rutherford
Já no século XX, o físico Ernest Rutherford fez experimentos com polônio e radioatividade. Para isso, ele bombardeou uma fina lâmina de ouro com partículas alfa — a maioria delas atravessava o objeto com facilidade, mas uma pequena porção delas tinha sua trajetória desviada.
Com essas observações, ele percebeu que o átomo era composto de uma região maciça chamada de núcleo e outra vazia, que ele chamou de eletrosfera. Ao agregar essas ideias, ele propôs um modelo atômico em que:
- O núcleo é maciço e positivo;
- Os elétrons estão dispostos em uma eletrosfera não maciça; e
- As partículas negativas orbitam o núcleo, tal qual o sol é orbitado por planetas.
Na afirmação abaixo, que apareceu na prova da Aman, todos os elementos apontam para o modelo de Rutherford-Bohr: o núcleo com carga positiva e o planetário com elétrons:
“No modelo de Rutherford, os átomos são constituídos por um núcleo muito pequeno e denso e carregado positivamente. Ao redor do núcleo estão distribuídos os elétrons, como planetas em torno do Sol.”
Nessa questão, portanto, a afirmativa deveria ser considerada verdadeira.
Niels Bohr
A partir do modelo atômico proposto por Rutherford, o físico dinamarquês Niels Bohr propôs algumas novas ideias sobre a estrutura da matéria:
- O átomo é muito pequeno e, mesmo assim, a maior parte de sua composição é vazia;
- Os elétrons circundam o núcleo a partir de órbitas determinadas, conforme a quantidade energética; e
- Quando um elétron passa de uma órbita para outra, ele é excitado e emite luz.
Posteriormente, novos estudiosos se debruçaram sobre o assunto e evoluíram os conhecimentos, como:
- James Chadwick, que foi responsável por perceber a existência do nêutron, como uma carga neutra que afasta os prótons no núcleo; e
- Louis de Broglie, que notou os elétrons orbitando o núcleo, mas não por meio das camadas definidas, refutando algumas das teorias de Bohr, entre diversos outros cientistas que se dedicam à atomística.
Aprofunde seu conhecimento sobre modelos atômicos
Além de ler a matéria, muitas vezes é necessário uma explicação expositiva sobre o assunto. Para isso, você pode assistir a aula sobre modelos atômicos que está disponível gratuitamente no canal do youtube do Estratégia Vestibulares. Dê o play!
Você sabia que a Coruja possui mais de 1800 alunos aprovados em faculdades públicas em um só ano? Clique no banner abaixo e conheça os planos oferecidos pelo Estratégia vestibulares, você pode ser o próximo a conquistar a vaga dos sonhos!
Veja Também
- Tabela periódica completa e atualizada
- Atomística: estrutura e características
- Partículas subatômicas: principais tipos e características
- Ligações químicas: tipos, características e exercícios
- Geometria molecular: o que é, quais são e exemplos
- Polaridade molecular: o que é, como acontece e exercícios
- Distribuição eletrônica: níveis de energia, diagrama e como usar
- Ligações iônicas: o que são, como fazer?
- Oxirredução: troca de elétrons e balanceamento
- Resolução Comentada Prova de Química Fuvest 2020
- Resolução da prova de Química da 2ª Fase da Fuvest 2020