Quando as substâncias passam por reações químicas, os átomos são reorganizados, o que resulta em compostos e moléculas diferentes das iniciais. São fenômenos da natureza que ocorrem o tempo todo ao nosso redor e até mesmo dentro dos seres vivos, inclusive os humanos.
Essas reações químicas podem ser classificadas em diferentes tipos, a depender da forma que as substâncias iniciais reagem e quais produtos são gerados ao final do processo. Aprenda sobre cada uma delas e acompanhe exemplos de como esse tema pode aparecer em vestibulares.
Navegue pelo conteúdo
O que são reações químicas?
Toda a matéria conhecida e estudada é formada por átomos e, ao longo do tempo, as substâncias podem passar por diferentes transformações. Algumas são essencialmente físicas, como a mudança entre vapor e líquido — a substância é a mesma, mas sua apresentação física está alterada.
Enquanto isso, as reações químicas estão relacionadas com um rearranjo dos átomos que estão dentro do sistema. Nesse caso, podem surgir novas moléculas, novos compostos, com comportamentos e propriedades diferentes dos materiais iniciais.
Na cozinha, por exemplo, é possível observar transformações físicas, quando como a água evapora durante o cozimento do arroz. Mas as reações químicas também acontecem, como a mistura entre bicarbonato de sódio e vinagre, quando deseja-se desinfectar alguns alimentos — nesse caso, as moléculas de vinagre e do bicarbonato geram dois compostos diferentes: sal e água.
Conceitos em reações químicas
Para continuar o estudo, vamos definir alguns conceitos importantes deste tema. As substâncias que são colocadas inicialmente dentro do sistema são chamadas de reagentes, ou seja, aquelas que vão reagir entre si.
Quando as condições são adequadas, em termos de temperatura, energia, meio, pressão e volume, haverá a reação química. Diante disso, os átomos se reorganizam gerando as novas moléculas, que são denominadas de produtos.
Para representar isso graficamente, está padronizado que os reagentes ficam “atrás da seta”, geralmente no lado esquerdo. Depois vem uma setinha que aponta no sentido dos produtos, é comum que aponte para a direita, onde ficam essas novas substâncias formadas.
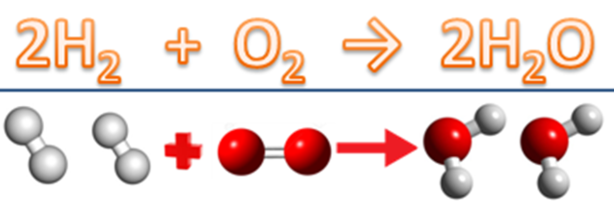
A imagem abaixo mostra tanto a notação em fórmulas moleculares como um diagrama com átomos no modelo de Dalton. Então, a escrita é dada como está demonstrado na parte superior, enquanto que o rearranjo atômico está bem descrito com a formação das moléculas de água.
Tipos de reações químicas
É possível classificar as reações químicas pela forma como o rearranjo acontece. Por vezes, todos os átomos são reorganizados, em outros momentos, apenas um átomo migra e as substâncias formadas são novas, entre outros exemplos. Acompanhe uma explicação sobre cada tipo a seguir.
Reação de adição ou síntese
Como o nome indica, uma reação química de adição acontece quando duas substâncias são somadas entre si. Nesse caso, os átomos do reagente A são aderidos aos átomos do reagente B e juntos, eles formam uma nova molécula como produto, que pode ser chamada de AB.
A + B → AB
Exemplo: 2H2 + O2 → 2 H2O
Reação de decomposição ou análise
A decomposição é uma reação química diretamente inversa ao que vimos anteriormente. Acontece quando uma molécula é “quebrada” em produtos diferentes, então é um único reagente que formará alguns produtos, a quantidade de moléculas novas depende das condições e características de cada reação.
AB → A + B
Exemplo: CaCO3 → CaO + CO2
Reação de deslocamento ou substituição
A reação de deslocamento trata de situações em que o átomo de uma substância AB é enviado para a substância C ou vice-versa. Nesse caso, há uma “simples troca” entre os dois reagentes, como está representado a seguir.
AB + C → AC + B ou AB + C → A + BC
Exemplo: Zn + 2HCl → ZnCl2 + H2
Reação de dupla-troca ou dupla substituição
As reações químicas do tipo dupla-troca acontecem, justamente, pela alternância de átomos entre os reagentes, depois de todo o processo. É como se eles permutassem as estruturas atômicas, o que gerará produtos, como está descrito abaixo.
AB + CD → AC + BD ou AB + CD → AD + BC
Exemplo: NaOH + HBr → NaBr + H2O
Balanceamento de reações químicas
Uma parte importante do estudo da matéria é o balanceamento das reações químicas. Para realizar isso, parte-se do princípio que nenhuma matéria pode nascer dentro do sistema, ou seja, tudo que entra deve ser igual a tudo que sai.
Assim, apesar de todas as transformações e rearranjos estruturais, o número de átomos encontrados nos reagentes é igual a esse número do lado dos produtos. Diante disso, o balanceamento de uma equação química (representação matemática para as reações) é tão importante para que a notação seja verdadeira e pária à realidade.
Diante disso, existem as leis ponderais que versam sobre a quantidade de massa em um sistema e a proporção encontrada nas reações químicas.
Leis ponderais
Conservação das massas (Lei de Lavoisier)
A famosa frase “na natureza nada se cria, nada se perde, tudo se transforma” foi enunciada pelo químico francês Antoine Lavoisier. Foi a partir disso que se percebeu que se, em uma reação química, é adicionada uma massa de reagentes de valor M, ao final do processo, a soma das massas dos produtos também deve ser M.
CaO + CO2 → CaCO3
- Reagentes:
- CaO tem massa 40 + 16 = 56
- CO2 tem massa 12 + 2.16 = 44
- Massa REAGENTES = 100
- Produtos:
- CaCO3 40 + 12 + 3.16.
- Massa PRODUTOS = 100
Lei das proporções constantes
As proporções constantes são observadas em reações químicas balanceadas. Isso significa que a quantidade de produto formada é proporcional à quantidade de reagentes adicionados no início do processo. Esse cálculo, conhecido como Lei de Proust, deve ser feito a partir da massa, mas estudos comprovam que é possível manter a proporcionalidade avaliando outras propriedades também.
CaO + CO2 → CaCO3
No exemplo acima 44 gramas de CO2 formam 100 gramas de CaCO3. Então, quantas gramas de dióxido de carbono são necessárias para formar 300 gramas de CaCO3?
44 gramas de CO2 ——- 100 gramas de CaCO3
x gramas de CO2 ——– 300 gramas de CaCO3
x.100 = 44.300
x = 44.3
x = 132 gramas de CO2
+ Veja também: Reações orgânicas: o que são e classificações
Questão sobre reação química
(UFMG)
Todos os fenômenos descritos são exemplos de reações químicas, exceto:
a) dissolução de um comprimido efervescente.
b) eletrólise da água.
c) enferrujamento de um prego exposto ao ar.
d) fusão de parafina.
e) queima de uma vela.
Estude com a Coruja!
O Estratégia Vestibulares se preocupa com a qualidade dos seus estudos, porque somente conteúdos qualificados podem te ajudar na rotina rumo a aprovação. É por isso que nossas aulas são formuladas e ministradas por professores especialistas, que entendem da disciplina e entendem de vestibulares. Clique no banner e tenha acesso a conteúdos exclusivos!




