Modelos atômicos, como o próprio nome sugere, são modelos criados por cientistas para explicar a matéria, ou seja, os átomos, e seus comportamentos e fenômenos. A Química atual considera quatro principais modelos atômicos: Modelo de Dalton ou Bola de Bilhar (1803), Modelo de Thomson ou Pudim de Passas (1903), Modelo de Rutherford (1911) e Modelo de Bohr (1913).
Para entender como as bancas dos vestibulares cobram o assunto nas provas, reunimos questões sobre modelos atômicos que já caíram nos vestibulares, retiradas do Banco de Questões do Estratégia Vestibulares, e que irão ajudar nos seus estudos. Confira:
Saiba mais:
+ Modelos atômicos: história e evolução
+ Partículas subatômicas: principais tipos e características
+ Ligações químicas: tipos, características e exercícios
Navegue pelo conteúdo
Universidade Federal do Amazonas (Ufam) 2017
Ao fundamentar o conceito de átomo, os filósofos da antiga Grécia tentavam explicar a natureza do mundo em que viviam, criando uma base lógica para a existência das coisas. Por portentoso que fosse já esse primeiro objetivo acabou tornando-se acanhado frente às descobertas e invenções tecnológicas que esse conceito possibilitou nos últimos séculos (Química Nova na Escola – N° 3, Maio, 1996). O modelo atômico evoluiu, indo em um enorme salto de Rutherford para as ideias de Bohr. Leia atentamente as afirmações a seguir e relacione-as com os seus respectivos modelos.
I. O átomo possui espaços vazios (eletrosfera).
II. O átomo é uma esfera que tem massa positiva e os elétrons, carga negativa, ficavam distribuídos quase que uniformemente, como as passas em um pudim.
III. Os elementos são formados por pequeníssimas partículas, os átomos.
IV. A eletrosfera está dividida em sete níveis ou camadas eletrônicas.
V. Os átomos de um determinado elemento são diferentes dos átomos de outro elemento e o que os diferencia são suas massas relativas.
VI. O átomo possui uma região central que é densa, pequena e positiva denominada núcleo.
VII. O átomo possui as seguintes características: divisível, maciço e esférico.
VIII. O elétron, ao orbitar por uma camada ou nível, não ganha e nem perde energia, ou seja, sua energia é constante.
Assinale a alternativa CORRETA:
A) As afirmações I e V pertencem ao modelo atômico de Dalton; as afirmações III e V pertencem ao modelo atômico de Thomson; as afirmações IV e VIII pertencem ao modelo atômico de Rutherford; e as afirmações II e VI pertencem ao modelo atômico de Rutherford-Bohr.
B) As afirmações I e V pertencem ao modelo atômico de Dalton; as afirmações II e VI pertencem ao modelo atômico de Thomson; as afirmações IV e VIII pertencem ao modelo atômico de Rutherford; e as afirmações II e VI pertencem ao modelo atômico de Rutherford-Bohr.
C) As afirmações II e VI pertencem ao modelo atômico de Dalton; as afirmações III e V pertencem ao modelo atômico de Thomson; as afirmações IV e VIII pertencem ao modelo atômico de Rutherford; e as afirmações I e V pertencem ao modelo atômico de RutherfordBohr.
D) As afirmações III e IV pertencem ao modelo atômico de Dalton; as afirmações II e VI pertencem ao modelo atômico de Thomson; as afirmações IV e VIII pertencem ao modelo atômico de Rutherford; e as afirmações I e V pertencem ao modelo atômico de RutherfordBohr.
E) As afirmações III e IV pertencem ao modelo atômico de Dalton; as afirmações II e VI pertencem ao modelo atômico de Thomson; as afirmações I e V pertencem ao modelo atômico de Rutherford; e as afirmações IV e VIII pertencem ao modelo atômico de Rutherford-Bohr.
Resolução: A alternativa E está correta.
Universidade Federal do Tocantins (UFT) 2023
Na Índia antiga, na província de Bengala, a população produzia uma mistura de sais, enxofre e carvão. Ao entrar em combustão, essa mistura produzia chamas com diversas cores. Esse experimento ficou conhecido como o “fogo de Bengala”. É possível construir “chamas coloridas” semelhante ao fogo de Bengala, misturando-se nitratos de alguns metais alcalinos ou alcalino-terrosos com açúcares e perclorato de potássio (KClO₄). O nitrato de estrôncio, Sr(NO₃)₂ produz uma chama vermelha.
O nitrato de bário, Ba(NO₃)₂, por sua vez, produz a cor verde e o nitrato de sódio, NaNO3, gera uma cor amarela. Sobre o experimento do “fogo de Bengala”, assinale a alternativa INCORRETA.
A) As cores observadas são produzidas pelas transições eletrônicas entre os níveis eletrônicos nos átomos.
B) O primeiro modelo atômico a incorporar a quantização da energia dos níveis eletrônicos foi o modelo atômico de Sommerfeld.
C) O modelo atômico de Dalton não é capaz de explicar as cores observadas no experimento, uma vez que se trata de um modelo atômico sem partículas eletricamente carregadas.
D) No modelo atômico de Thomson, os elétrons estão presentes, mas não são descritos com seus valores de energia quantizados.
Resolução: A alternativa B está correta.
Universidade de Vila Velha (UVV) 2018
Ao longo da história da Química, diversos modelos atômicos foram propostos até chegarmos no modelo atômico atual. A respeito dos modelos proposto, é correto afirmar que:
A) Segundo o modelo de Bohr, quando o elétron passa de um nível de energia externo para outro mais interno, emite um quantum de energia.
B) Segundo o modelo proposto por Dalton, em uma reação, um átomo de qualquer elemento pode ser transformado em um átomo de outro elemento.
C) Rutherford considerou que o átomo é constituído de uma estrutura altamente compacta de prótons e elétrons.
D) O átomo, segundo Thomson, é constituído de núcleo e eletrosfera.
E) Chadwick foi o primeiro cientista a utilizar a palavra átomo.
Resolução: A alternativa A está correta.
Universidade do Oeste do Paraná (Unioeste) 2013
A evolução do modelo atômico envolveu conhecimento de estequiometria, radiatividade, raio X, etc. Dentre os modelos propostos, temos o modelo atômico de Thomson, conhecido como “pudim de passas”. Segundo este modelo, é correto afirmar que
A) ele explica adequadamente a distribuição eletrônica e a existência de orbitais atômicos.
B) ele explica adequadamente a existência de íon.
C) ele propõe a existência de um núcleo maciço.
D) segundo este modelo o núcleo é composto de carga positiva.
E) segundo este modelo existem órbitas ao redor do núcleo.
Resolução: A alternativa B está correta.
Universidade do Estado de Santa Catarina (Udesc) 2016
Considerando os modelos atômicos mais relevantes, dentro de uma perspectiva histórica e científica, assinale a alternativa correta.
A) Até a descoberta da radioatividade, o átomo era tido como indivisível (Dalton). O modelo que o sucedeu foi de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons distribuídos nela.
B) No modelo de Dalton, o átomo era constituído de um núcleo carregado positivamente e uma eletrosfera. O modelo seguinte foi o de Bohr que introduziu a ideia de que os elétrons ocupam orbitais com energias definidas, este modelo se assemelha ao modelo do sistema solar.
C) No modelo atômico de Dalton, o átomo era tido como indivisível. O modelo sucessor foi o de Rutherford, no qual o átomo era constituído de um núcleo carregado negativamente e uma eletrosfera.
D) O modelo de Dalton propunha que o átomo era formado por uma massa carregada positivamente com os elétrons distribuídos nela. O modelo seguinte foi o de Rutherford, no qual o átomo era constituído de um núcleo carregado positivamente e uma eletrosfera.
E) No modelo atômico de Dalton, os elétrons ocupam orbitais com energias definidas, este modelo se assemelha ao do sistema solar. O modelo que o sucedeu foi o de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons distribuídos nela.
Resolução: A alternativa A está correta.
Universidade Federal de Uberlândia (UFU) 2008
Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos é correto afirmar que o
A) Modelo de Bohr propôs que um elétron em um átomo só poderia ter certas energias específicas e cada uma dessas energias corresponderia a uma órbita particular. Ao receber energia, um elétron poderia saltar para um nível menos energético.
B) Modelo de Dalton apresentava como características do modelo atômico os átomos com núcleo denso e positivo, rodeado pelos elétrons negativos.
C) Modelo de Rutherford foi proposto a partir de estudos da determinação das leis Ponderais das Combinações Químicas.
D) Modelo de Thomson sugeria que os raios catódicos fossem constituídos por cargas elétricas negativas, transportadas por partículas de matéria. Assim, Thomson propôs que os elétrons fossem uma parte constituinte da matéria.
Resolução: A alternativa D está correta. Através do experimento com raios catódicos, Thompson descobriu a relação carga-massa. Com isso, ele propôs que os elétrons fossem parte constituinte da matéria.
Universidade Estadual Paulista (Unesp) 2009
Na evolução dos modelos atômicos, a principal contribuição introduzida pelo modelo de Bohr foi:
A) a indivisibilidade do átomo.
B) a existência de nêutrons.
C) a natureza elétrica da matéria.
D) a quantização de energia das órbitas eletrônicas.
E) a maior parte da massa do átomo está no núcleo.
Resolução: A alternativa D está correta. As principais inovações trazidas por Bohr foram os seus postulados:
• O elétron é capaz de girar em torno do núcleo mantendo órbitas estacionárias circulares sem irradiar nenhum tipo de energia;
• O momento angular dos elétrons é quantizado e somente pode atingir valores múltiplos da Constante de Planck reduzida (comumente chamada de “h cortado”):
𝐿 = 𝑛ℎ̅ = 𝑛ℎ/2𝜋
• Elétrons somente podem ganhar ou perder energia saltando de uma órbita permitida para outra, absorvendo ou emitindo radiação eletromagnética com frequência calculada pela Equação de Planck.
Devido a esses postulados, principalmente, o segundo e o terceiro, a visão do átomo de Bohr é um elétron girando em torno do núcleo seguindo apenas um conjunto de níveis de energia permitidos. Portanto, as órbitas possíveis para os elétrons são quantizadas.
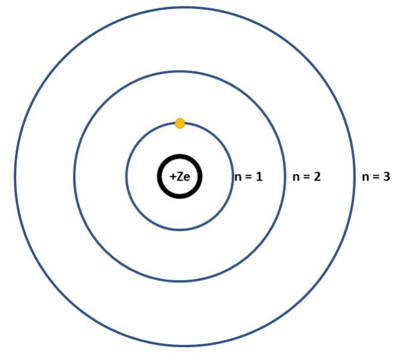
Universidade Estadual do Centro-Oeste (Unicentro) 2021
O desenvolvimento dos modelos atômicos é um excelente exemplo de como os modelos científicos se desenrolam e são, constantemente, revisados. O modelo atual foi desenvolvido a partir de estudos de diferentes pesquisadores e séries de experimentos.
Sobre os modelos atômicos, assinale a alternativa correta.
A) Segundo Bohr, os elétrons circulam ao redor do núcleo em determinadas órbitas de energia.
B) Segundo Dalton, átomos são esferas constituídas de partículas subâtomicas.
C) J. J. Thomson propôs a existência de partículas positivas (prótons) em uma esfera negativa.
D) Segundo Rutherford, o átomo tem o núcleo positivo mais leve, com elétrons pesados ao redor.
E) Segundo o modelo de subníveis de energia, um átomo com Z=22 tem configuração
Resolução: A alternativa A está correta.
Universidade Federal de Viçosa (UFV) 2016
Os fogos de artifício quando incendiados emitem diferentes colorações, porque utilizam sais de diferentes cátions metálicos misturados com um material explosivo. Por exemplo, sais de sódio emitem cor amarela, sais de cálcio emitem cor vermelha e sais de cobre emitem cor azul. As cores são produzidas quando os elétrons excitados dos íons metálicos retornam para níveis de menor energia. Esse fenômeno pode ser simulado em laboratório através do aquecimento de uma pequena porção do sal em uma chama de gás, como ilustrado na figura abaixo:
Desde o início do século XIX, diversos modelos atômicos foram propostos na tentativa de elucidar a matéria. É CORRETO afirmar que o modelo mais adequado para explicar esse fenômeno é:
A) o modelo de Dalton.
B) o modelo de Rutherford.
C) o modelo de Rutherford-Bohr.
D) o modelo de Thomson.
Resolução: A alternativa C está correta.
Saiba mais sobre as questões cobradas nos vestibulares
- 13 questões sobre Citologia que já caíram nos vestibulares e no Enem
- 11 questões sobre globalização que já caíram nos vestibulares
- 9 questões sobre Revolução Industrial que já caíram no Enem e demais vestibulares
- 11 questões sobre racismo que podem cair ou já caíram no vestibular
- 15 questões sobre filmes brasileiros que já caíram nos vestibulares
- 9 questões sobre genética que já caíram nos vestibulares e Enem
- 11 questões sobre aquecimento global que já caíram nos vestibulares
- 7 questões sobre Platão e o mito da caverna
- 11 questões sobre Revolução Francesa que já caíram nos vestibulares e no Enem
Prepare-se para a prova com o Estratégia Vestibulares
O Estratégia Vestibulares oferece diariamente aulas gratuitas no YouTube sobre todas as matérias que caem nos principais vestibulares do Brasil!
Além disso, para aqueles que querem investir nos estudos, a plataforma também oferece cursos preparatórios focados em cada uma das bancas, com professores especialistas na prova e com diversos benefícios. Dá só uma olhada:
- Curso com livros digitais;
- Correção ilimitada de redações;
- Fórum de dúvidas;
- Simulados com questões inéditas;
- Questões comentadas;
- Mapas mentais; e
- Entre muitas outras vantagens.
Ficou interessado? Então, clique no banner e veja tudo sobre os cursos oferecidos pelo Estratégia Vestibulares!



